- Beiträge: 1751
Sidebar
Parodontitis verschlimmert die pulmonale Hypertonie
28 Mär 2024 13:14 #2054
von danny
OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
Parodontitis verschlimmert die pulmonale Hypertonie wurde erstellt von danny
www.nature.com/articles/s41368-024-00291-2
AbstraktDie Aufklärung der Risikofaktoren der pulmonalen Hypertonie und ihrer Mechanismen ist für die Prävention und Behandlung der Krankheit von entscheidender Bedeutung. In der aktuellen Studie haben wir gezeigt, dass eine experimentelle Parodontitis, die durch Unterbindung von Molaren und anschließendes orales Verschmieren subgingivaler Plaques von Patienten mit Parodontitis festgestellt wurde, die durch Hypoxie verursachte pulmonale Hypertonie bei Mäusen verschlimmerte. Mechanistisch führte die Parodontitis zu einer Fehlregulierung der pulmonalen Mikrobiota, indem sie die ektopische Kolonisierung und Anreicherung oraler Bakterien in der Lunge förderte, was zur pulmonalen Infiltration von Interferon-Gamma-positiven (IFNγ + ) T-Zellen beitrug und das Fortschreiten der pulmonalen Hypertonie verschlimmerte. Darüber hinaus identifizierten wir Prevotella zoogleoformans als das kritische Parodontitis-assoziierte Bakterium, das die Verschlimmerung der pulmonalen Hypertonie durch Parodontitis verursacht, und die Verschlimmerung wurde sowohl durch die Entfernung zervikaler Lymphknoten als auch durch neutralisierende IFNγ-Antikörper wirksam gelindert. Unsere Studie legt einen Proof of Concept nahe, dass die kombinierte Prävention und Behandlung von Parodontitis und pulmonaler Hypertonie notwendig sind.EinführungPulmonale Hypertonie (PH) ist nach wie vor eine ernste Erkrankung mit schlechter Prognose. 1 PH ist eine fortschreitende Erkrankung, die durch die allmähliche Zerstörung der Lungenarterien (PAs), erhöhten pulmonalarteriellen Druck sowie Hypertrophie und Umbau des rechten Ventrikels (RV) gekennzeichnet ist und in RV-Versagen und Tod gipfelt. 2 Zu den häufigen pathologischen Merkmalen gehören die Umgestaltung des distalen PA und die Infiltration von Entzündungszellen. 3 Begrenzte Behandlungsmöglichkeiten für PH verdeutlichen den dringenden Bedarf an mehr therapeutischen Zielen. 4 Es gibt immer mehr Hinweise darauf, dass es sich bei PH um eine systemische Erkrankung handelt, die von der Mikrobiota beeinflusst wird. 5 , 6 , 7 , 8 , 9 , 10 Darüber hinaus hat die Rolle der Darm-Lungen-Achse bei PH zunehmende Aufmerksamkeit erregt. 5 , 7 Zahlreiche Studien haben den Zusammenhang zwischen PH und dem Magen-Darm-Trakt untersucht und dabei eine proinflammatorische Darmmikrobiota und veränderte mikrobielle Metaboliten bei Personen mit PH aufgedeckt. 11 , 12 , 13 , 14 Darüber hinaus verzögert der Abbau der Darmmikrobiota durch Antibiotikaeingriffe die PH-Entwicklung in einem Rattenmodell. 15 Andererseits hat die Bedeutung der Mund-Lungen-Achse bei Atemwegserkrankungen an Bedeutung gewonnen. Es wird vermutet, dass der Mundgesundheitszustand ein entscheidender Faktor für die Lungengesundheit ist, da die Mikroben aus der Mundhöhle nach dem Einatmen in die unteren Atemwege Atemwegsinfektionen und Entzündungen auslösen können. 16 , 17 , 18 Darüber hinaus wurden Zusammenhänge zwischen oraler Dysbiose, insbesondere Parodontitis, und verschiedenen Atemwegserkrankungen beobachtet. 17 , 19 , 20 Die spezifische Rolle der oralen Mikrobiota bei der Aufrechterhaltung der Lungenhomöostase während PH bleibt jedoch weitgehend unerforscht.Parodontitis dient als paradigmatisches Beispiel für ein orales mikroökologisches Ungleichgewicht mit epidemiologischen Verbindungen zu verschiedenen systemischen Erkrankungen, einschließlich Infektionen der Atemwege. 21 Der Zusammenhang zwischen Parodontitis und systemischen Komorbiditäten wird häufig durch lokale und systemische Immunreaktionen auf orale Krankheitserreger vermittelt. 22 Darüber hinaus gibt es substanzielle Hinweise darauf, dass Entzündungen eine Schlüsselrolle bei menschlicher und experimenteller PH spielen. 23 In umgestalteten Lungenarterien bei Patienten mit PH wird eine Infiltration von Immunzellen beobachtet, an der hauptsächlich T- und B-Lymphozyten, Makrophagen, Monozyten, Mastzellen und dendritische Zellen beteiligt sind. 24 , 25 Darüber hinaus wurden in Tiermodellen und bei Patienten mit PH hohe Konzentrationen an Zytokinen, Chemokinen und Autoantikörpern festgestellt, was auf lokale adaptive Immunantworten in der Lunge schließen lässt. 25 , 26 Daher könnte die Erforschung der Wechselwirkung zwischen der oralen Mikrobiota und der Immunität bei PH neue therapeutische Erkenntnisse für die Behandlung von PH liefern.Unser Hauptziel in dieser Studie war es, den kausalen Zusammenhang zwischen Parodontitis und PH zu untersuchen und die zugrunde liegenden Mechanismen zu identifizieren. Zunächst verwendeten wir ein zusammengesetztes Mausmodell, das ein experimentelles Parodontitismodell mit einer durch Hypoxie induzierten PH kombinierte, um den Einfluss von Parodontitis auf die PH zu untersuchen. Anschließend führten wir eine umfassende Analyse der Mund- und Lungenmikrobiota durch, um die zentralen oralen Mikroben zu identifizieren, die am Einfluss der Parodontitis auf das pathologische Fortschreiten der PH beteiligt sind. Als nächstes untersuchten wir die Auswirkungen oraler Mikroben auf die Immunantwort während PH. Schließlich wurden neutralisierende Antikörper verwendet, um zu beurteilen, ob die Immunantwort die Wirkung oraler Mikroben auf die Verschlimmerung der PH vermittelte.ErgebnisseParodontitis verschlimmert den durch Hypoxie verursachten PH bei MäusenUm den Einfluss der Parodontitis auf das Fortschreiten der PH bei Mäusen zu untersuchen, haben wir ein Maus-Parodontitis-Modell erstellt, indem wir die bilateralen zweiten Molaren des Oberkiefers mit Seidennaht abgebunden und subgingivale Plaques von Parodontitis-Patienten zwei Wochen lang verschmiert haben (das zusammengesetzte Modell wurde als PD bezeichnet). . Anschließend wurden die Mäuse 3 Wochen lang einer Hypoxie ausgesetzt, um PH zu induzieren (Abb. 1a ). Wie erwartet führte Parodontitis bei Mäusen unter normoxischen und hypoxischen Bedingungen zu einem erheblichen Alveolarknochenverlust (Abb. S1 a und S1b ). Eine erhöhte RV-Nachlast ist eine Folge eines erhöhten Lungenkreislaufdrucks, der schließlich zu RV-Hypertrophie und Dysfunktion führt. 27 Mäuse in der PH + PD-Gruppe zeigten im Vergleich zu Mäusen in der PH-Gruppe einen signifikanten Anstieg des rechtsventrikulären systolischen Drucks (RVSP) und des Fulton-Index, zwei Marker für RV-Hypertrophie (Abb. 1 b, c). Bei Mäusen ohne PH hatte Parodontitis jedoch keinen Einfluss auf RVSP oder Fulton-Index (Abb. 1 b, c). Eine Verringerung des Verhältnisses von Lungenarterienbeschleunigung zu Auswurfzeit (PAT/PET) weist häufig auf eine beeinträchtigte Lungengefäßfunktion bei PH-Mäusen hin. Die Echokardiographie zeigte ein geringeres PAT/PET-Verhältnis bei PH + PD-Mäusen als bei PH-Mäusen, es wurde jedoch kein Unterschied zwischen PD-Mäusen und Ctrl-Mäusen beobachtet (Abb. 1 d, e). Um die Kardiomyozytenhypertrophie des rechten Ventrikels zu bewerten, führten wir eine Weizenkeimagglutinin (WGA)-Färbung von Mausherzschnitten durch. Die Ergebnisse zeigten eine größere Kardiomyozytengröße bei PH + PD-Mäusen im Vergleich zu PH-Mäusen (Abb. 1 f, g). Darüber hinaus zeigten die Hämatoxylin- und Eosin-Färbung (H&E) (Abb. 1 h, i) und die Immunfluoreszenzfärbung von Lungenschnitten (Abb. 1 j, k) deutlich verdickte mediale Wände und einen Anstieg der α-Glattmuskel-Aktin-Positivität (α-SMA). + ) Bereiche in distalen PAs von PH + PD-Mäusen im Vergleich zu PH-Mäusen, was auf einen stärkeren Gefäßumbau der Lungenarterie bei PH + PD-Mäusen als bei PH-Mäusen hindeutet. Insgesamt zeigten unsere Daten, dass Parodontitis das Fortschreiten der durch Hypoxie verursachten PH verschlimmerte.Abb. 1
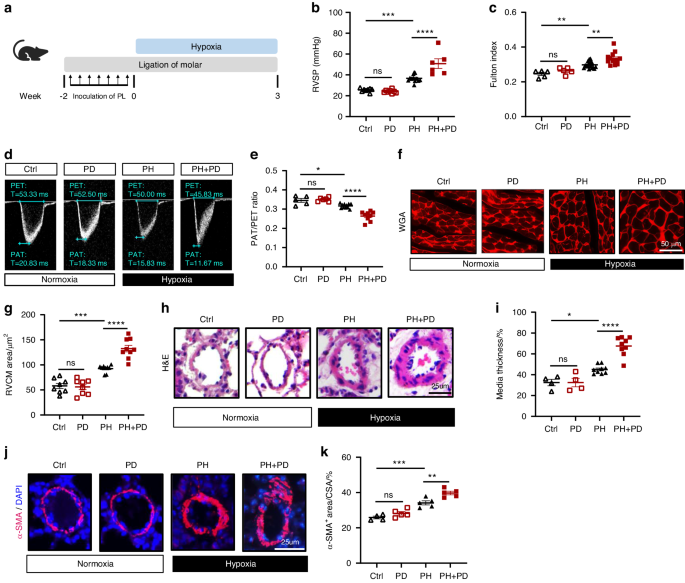 Parodontitis (PD) verschlimmert die pulmonale Hypertonie (PH) bei Mäusen. a Schematische Darstellung des Versuchsaufbaus. Die Parkinson-Krankheit wurde durch die Ligatur der Molaren (in Woche -2) in Kombination mit einer siebenmaligen Inokulation subgingivaler Plaques (PL) von Patienten mit Parodontitis induziert. Mäuse wurden 3 Wochen lang in einer belüfteten Kammer Normoxie (21 % O 2 ) oder Hypoxie (10 % O 2 ) ausgesetzt. b , c Rechtsventrikulärer systolischer Druck (RVSP) b und Fulton-Index c , bestimmt durch das Verhältnis des Gewichts des rechten Ventrikels (RV) zum Gewicht des linken Ventrikels (LV) plus Septumgewicht (RV/(LV + S)). n = 8:8:8:12 für RVSP, n = 5:5:16:13 für den Fulton-Index. d , e Repräsentative Echokardiographiebilder d und Messungen der Lungenarterienfunktion (PA) anhand des Verhältnisses von PA-Beschleunigungszeit zu Auswurfzeit (PAT/PET) e nach 3-wöchiger Exposition gegenüber Normoxie oder Hypoxie. n = 5:5:11:9. f Repräsentative Weizenkeim-Agglutinin-Färbung (WGA) von RV-Schnitten. g Quantifizierung der RV-Kardiomyozyten (RVCM)-Fläche basierend auf WGA-Färbung. n = 8:8:9:9. h Repräsentative Hämatoxylin- und Eosin-Färbung (H&E) von Lungenschnitten. i Quantifizierung der medialen Dicke als Prozentsatz des Außendurchmessers von PAs. n = 4:4:9:9. j Repräsentative Immunfluoreszenzfärbung von Alpha-Glattmuskel-Aktin (α-SMA) in Lungenschnitten. k Quantifizierung der α-SMA + -Fläche als Prozentsatz der Querschnittsfläche (CSA) von PAs. n = 4:5:5:5. Strg, nichtligaturierte Steuerung. PD, ligaturinduzierte Parodontitis mit oraler Infektion von PL. PH, pulmonale Hypertonie. Die Daten werden als Mittelwert ± SEM dargestellt. Für die statistische Analyse wurde die Zwei-Wege-ANOVA b , c , e , g , i , k verwendet. ns, nicht signifikant. * P < 0,05. ** P < 0,01. *** P < 0,001. **** P < 0,000 1
Parodontitis erhöht die Ansammlung von Prevotella zoogleoformans ( P. zoogleoformans ) in der Mundhöhle und Lunge von Mäusen mit PHAls nächstes nutzten wir die Sequenzierung des 16 S-rRNA-Gens in voller Länge, um bakterielle Veränderungen in der Mundhöhle und der Lunge der Mäuse zu untersuchen. Die α-Diversitätsanalyse ergab einen Anstieg des Chao1-Reichtums, der phylogenetischen Diversität von Faith und des beobachteten Artenreichtums in oralen Ligaturen und der Lunge von PH + PD-Mäusen im Vergleich zu PH-Mäusen (Abb.
2
a, b). Darüber hinaus wurden Unterschiede in der Bakterienzusammensetzung zwischen PH- und PH + PD-Tieren durch Hauptkoordinatenanalyse basierend auf Bray-Curtis-Abständen beobachtet (Abb.
2
c, d). Insgesamt waren die strukturellen Unterschiede in den Bakteriengemeinschaften signifikant, sodass die Proben in verschiedene Gruppen (PH und PH + PD) eingeteilt wurden. Diese Daten zeigten, dass Parodontitis die bakterielle Ökologie in der Mundhöhle und der Lungennische bei Mäusen deutlich veränderte.Abb. 2
Parodontitis (PD) verschlimmert die pulmonale Hypertonie (PH) bei Mäusen. a Schematische Darstellung des Versuchsaufbaus. Die Parkinson-Krankheit wurde durch die Ligatur der Molaren (in Woche -2) in Kombination mit einer siebenmaligen Inokulation subgingivaler Plaques (PL) von Patienten mit Parodontitis induziert. Mäuse wurden 3 Wochen lang in einer belüfteten Kammer Normoxie (21 % O 2 ) oder Hypoxie (10 % O 2 ) ausgesetzt. b , c Rechtsventrikulärer systolischer Druck (RVSP) b und Fulton-Index c , bestimmt durch das Verhältnis des Gewichts des rechten Ventrikels (RV) zum Gewicht des linken Ventrikels (LV) plus Septumgewicht (RV/(LV + S)). n = 8:8:8:12 für RVSP, n = 5:5:16:13 für den Fulton-Index. d , e Repräsentative Echokardiographiebilder d und Messungen der Lungenarterienfunktion (PA) anhand des Verhältnisses von PA-Beschleunigungszeit zu Auswurfzeit (PAT/PET) e nach 3-wöchiger Exposition gegenüber Normoxie oder Hypoxie. n = 5:5:11:9. f Repräsentative Weizenkeim-Agglutinin-Färbung (WGA) von RV-Schnitten. g Quantifizierung der RV-Kardiomyozyten (RVCM)-Fläche basierend auf WGA-Färbung. n = 8:8:9:9. h Repräsentative Hämatoxylin- und Eosin-Färbung (H&E) von Lungenschnitten. i Quantifizierung der medialen Dicke als Prozentsatz des Außendurchmessers von PAs. n = 4:4:9:9. j Repräsentative Immunfluoreszenzfärbung von Alpha-Glattmuskel-Aktin (α-SMA) in Lungenschnitten. k Quantifizierung der α-SMA + -Fläche als Prozentsatz der Querschnittsfläche (CSA) von PAs. n = 4:5:5:5. Strg, nichtligaturierte Steuerung. PD, ligaturinduzierte Parodontitis mit oraler Infektion von PL. PH, pulmonale Hypertonie. Die Daten werden als Mittelwert ± SEM dargestellt. Für die statistische Analyse wurde die Zwei-Wege-ANOVA b , c , e , g , i , k verwendet. ns, nicht signifikant. * P < 0,05. ** P < 0,01. *** P < 0,001. **** P < 0,000 1
Parodontitis erhöht die Ansammlung von Prevotella zoogleoformans ( P. zoogleoformans ) in der Mundhöhle und Lunge von Mäusen mit PHAls nächstes nutzten wir die Sequenzierung des 16 S-rRNA-Gens in voller Länge, um bakterielle Veränderungen in der Mundhöhle und der Lunge der Mäuse zu untersuchen. Die α-Diversitätsanalyse ergab einen Anstieg des Chao1-Reichtums, der phylogenetischen Diversität von Faith und des beobachteten Artenreichtums in oralen Ligaturen und der Lunge von PH + PD-Mäusen im Vergleich zu PH-Mäusen (Abb.
2
a, b). Darüber hinaus wurden Unterschiede in der Bakterienzusammensetzung zwischen PH- und PH + PD-Tieren durch Hauptkoordinatenanalyse basierend auf Bray-Curtis-Abständen beobachtet (Abb.
2
c, d). Insgesamt waren die strukturellen Unterschiede in den Bakteriengemeinschaften signifikant, sodass die Proben in verschiedene Gruppen (PH und PH + PD) eingeteilt wurden. Diese Daten zeigten, dass Parodontitis die bakterielle Ökologie in der Mundhöhle und der Lungennische bei Mäusen deutlich veränderte.Abb. 2
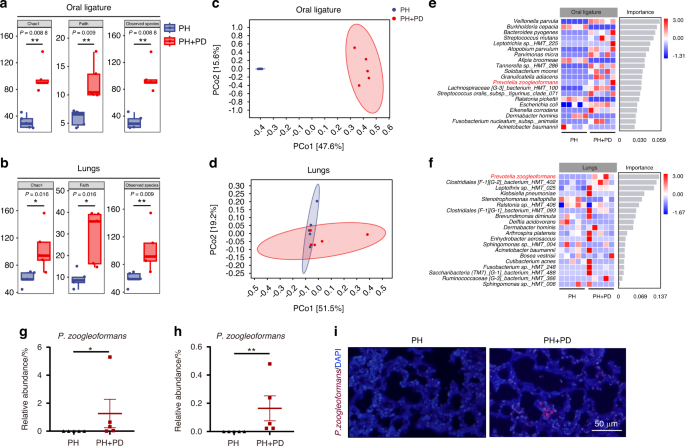 PD verändert sowohl die orale als auch die Lungenmikrobiota bei Hypoxie-induzierten PH-Mäusen. a , b Chao1, Faiths phylogenetische Vielfalt (Faith's) und beobachtete Arten von Mikrobiota in oraler Ligatur a und Lunge b . n = 5 pro Gruppe. c , d Hauptkoordinatenanalyse (PCoA) von Mikrobiota in oraler Ligatur c und Lunge d . n = 5 pro Gruppe. e , f Random-Forest-Regressionsanalyse der oralen e- und Lungen -f- Mikrobiota. Identifizierte Arten wurden nach Bedeutung und relativer Häufigkeit der angegebenen Arten in oralen Ligaturen und Lungen geordnet. n = 5 pro Gruppe. g , h Relative Häufigkeit von Prevotella zoogleoformans ( P. zoogleoformans ) in oralen Ligaturen g und Lungen h . n = 5 pro Gruppe. i Fluoreszenz-in-situ-Hybridisierung für P. zoogleoformans in Lungenschnitten. Die Daten werden als Mittelwert ± SEM dargestellt. Für die statistische Analyse wurde der Student- t- Test g , h verwendet. * P < 0,05. ** P < 0,01
Darüber hinaus wurden mikrobielle Unterschiede auf den Ebenen von Stamm zu Art analysiert, um festzustellen, ob es Bakterientaxa gab, die sich bei Parodontitis in der Lunge und der Mundhöhle in einem ähnlichen Trend veränderten. Interessanterweise war P. zoogleoformans , die Bakterienart mit dem höchsten Rang in der Lunge, gemäß der Zufallswald-Regressionsanalyse auch in der Mundhöhle von PH + PD-Mäusen im Vergleich zu PH-Mäusen angereichert (Abb.
2
e, f). Die Effektgröße der linearen Diskriminanzanalyse (LEfSe) zeigte konsistent, dass 14 Bakterienarten, einschließlich P. zoogleoformans , in der Mundhöhle der PH + PD-Gruppe angereichert waren, während 5 Bakterienarten in der PH-Gruppe angereichert waren (Abb.
S2
a und
S2b
). . Wie die relative Häufigkeit von Mikrobiota auf Artenebene zeigt, war P. zoogleoformans sowohl in der Mundhöhle als auch in der Lunge in der PH + PD-Gruppe im Vergleich zur PH-Gruppe signifikant angereichert (Abb.
2
g, h,
S2
c und
S2d
). Darüber hinaus wurde P. zoogleoformans in den Lungenabschnitten von PH + PD-Mäusen beobachtet, nicht jedoch in denen von PH-Mäusen, was darauf hindeutet, dass es sich nach der Parodontitis-Induktion ektopisch in der Lunge besiedelte (Abb.
2i
). Diese Ergebnisse zeigten insgesamt, dass Parodontitis die Fehlregulation der Mund- und Lungenmikrobiota und die Anreicherung von P. zoogleoformans in der Lunge von PH-Mäusen förderte.P. zoogleoformans fördert das Fortschreiten der PH bei MäusenUm den Beitrag von P. zoogleoformans zum Fortschreiten der PH zu untersuchen, wurden Mäuse entweder zwei Wochen lang oral mit P. zoogleoformans geimpft oder nicht und anschließend einer dreiwöchigen Hypoxiebehandlung unterzogen (Abb.
3a
). Die kombinierte Behandlung der P. zoogleoformans- Inokulation und der Ligatur von Molaren (Pz) trug zu einer signifikanten Alveolarknochenresorption bei, was auf eine erfolgreiche Modellierung der Parodontitis schließen lässt (Abb.
S3
a,
S3
b und
S3c
). RVSP und Fulton-Index waren bei PH + Pz-Mäusen im Vergleich zu PH-Mäusen alle signifikant erhöht, was darauf hindeutet, dass P. zoogleoformans den PH-Wert und die rechtsventrikuläre Dysfunktion bei Mäusen verschlechterte (Abb.
3
b, c). Stattdessen hatten Atopobium parvulum und Streptococcus mutans keinen Einfluss auf diese Parameter (Abb.
S4
a,
S4
b und
S4c
), was auf die spezifische Rolle von P. zoogleoformans bei der Förderung der PH schließen lässt. Die Echokardiographie ergab eine Abnahme des PAT/PET-Verhältnisses bei PH + Pz-Mäusen (Abb.
3
d, e). Konsistent zeigten PH + Pz-Mäuse einen deutlicheren Anstieg der Kardiomyozytengröße und der RV-Hypertrophie als PH-Mäuse (Abb.
3
f, g). Die histopathologischen Untersuchungen bestätigten einen schweren PH-assoziierten Gefäßumbau in der Lunge von PH + Pz-Mäusen, was sich in einer Zunahme der Wandstärke und α-SMA-positiven Bereichen der Lungenarterien zeigte (Abb.
3
h–j). Darüber hinaus zeigten die Ergebnisse der Fluoreszenz-in-situ-Hybridisierung das Vorhandensein von P. zoogleoformans in den Lungen von PH + Pz-Mäusen, nicht jedoch in denen von PH-Mäusen (Abb.
3k
). Alle diese Daten zusammengenommen ergaben, dass die orale Inokulation von P. zoogleoformans die durch Hypoxie verursachte PH stark verschlimmerte.Abb. 3
PD verändert sowohl die orale als auch die Lungenmikrobiota bei Hypoxie-induzierten PH-Mäusen. a , b Chao1, Faiths phylogenetische Vielfalt (Faith's) und beobachtete Arten von Mikrobiota in oraler Ligatur a und Lunge b . n = 5 pro Gruppe. c , d Hauptkoordinatenanalyse (PCoA) von Mikrobiota in oraler Ligatur c und Lunge d . n = 5 pro Gruppe. e , f Random-Forest-Regressionsanalyse der oralen e- und Lungen -f- Mikrobiota. Identifizierte Arten wurden nach Bedeutung und relativer Häufigkeit der angegebenen Arten in oralen Ligaturen und Lungen geordnet. n = 5 pro Gruppe. g , h Relative Häufigkeit von Prevotella zoogleoformans ( P. zoogleoformans ) in oralen Ligaturen g und Lungen h . n = 5 pro Gruppe. i Fluoreszenz-in-situ-Hybridisierung für P. zoogleoformans in Lungenschnitten. Die Daten werden als Mittelwert ± SEM dargestellt. Für die statistische Analyse wurde der Student- t- Test g , h verwendet. * P < 0,05. ** P < 0,01
Darüber hinaus wurden mikrobielle Unterschiede auf den Ebenen von Stamm zu Art analysiert, um festzustellen, ob es Bakterientaxa gab, die sich bei Parodontitis in der Lunge und der Mundhöhle in einem ähnlichen Trend veränderten. Interessanterweise war P. zoogleoformans , die Bakterienart mit dem höchsten Rang in der Lunge, gemäß der Zufallswald-Regressionsanalyse auch in der Mundhöhle von PH + PD-Mäusen im Vergleich zu PH-Mäusen angereichert (Abb.
2
e, f). Die Effektgröße der linearen Diskriminanzanalyse (LEfSe) zeigte konsistent, dass 14 Bakterienarten, einschließlich P. zoogleoformans , in der Mundhöhle der PH + PD-Gruppe angereichert waren, während 5 Bakterienarten in der PH-Gruppe angereichert waren (Abb.
S2
a und
S2b
). . Wie die relative Häufigkeit von Mikrobiota auf Artenebene zeigt, war P. zoogleoformans sowohl in der Mundhöhle als auch in der Lunge in der PH + PD-Gruppe im Vergleich zur PH-Gruppe signifikant angereichert (Abb.
2
g, h,
S2
c und
S2d
). Darüber hinaus wurde P. zoogleoformans in den Lungenabschnitten von PH + PD-Mäusen beobachtet, nicht jedoch in denen von PH-Mäusen, was darauf hindeutet, dass es sich nach der Parodontitis-Induktion ektopisch in der Lunge besiedelte (Abb.
2i
). Diese Ergebnisse zeigten insgesamt, dass Parodontitis die Fehlregulation der Mund- und Lungenmikrobiota und die Anreicherung von P. zoogleoformans in der Lunge von PH-Mäusen förderte.P. zoogleoformans fördert das Fortschreiten der PH bei MäusenUm den Beitrag von P. zoogleoformans zum Fortschreiten der PH zu untersuchen, wurden Mäuse entweder zwei Wochen lang oral mit P. zoogleoformans geimpft oder nicht und anschließend einer dreiwöchigen Hypoxiebehandlung unterzogen (Abb.
3a
). Die kombinierte Behandlung der P. zoogleoformans- Inokulation und der Ligatur von Molaren (Pz) trug zu einer signifikanten Alveolarknochenresorption bei, was auf eine erfolgreiche Modellierung der Parodontitis schließen lässt (Abb.
S3
a,
S3
b und
S3c
). RVSP und Fulton-Index waren bei PH + Pz-Mäusen im Vergleich zu PH-Mäusen alle signifikant erhöht, was darauf hindeutet, dass P. zoogleoformans den PH-Wert und die rechtsventrikuläre Dysfunktion bei Mäusen verschlechterte (Abb.
3
b, c). Stattdessen hatten Atopobium parvulum und Streptococcus mutans keinen Einfluss auf diese Parameter (Abb.
S4
a,
S4
b und
S4c
), was auf die spezifische Rolle von P. zoogleoformans bei der Förderung der PH schließen lässt. Die Echokardiographie ergab eine Abnahme des PAT/PET-Verhältnisses bei PH + Pz-Mäusen (Abb.
3
d, e). Konsistent zeigten PH + Pz-Mäuse einen deutlicheren Anstieg der Kardiomyozytengröße und der RV-Hypertrophie als PH-Mäuse (Abb.
3
f, g). Die histopathologischen Untersuchungen bestätigten einen schweren PH-assoziierten Gefäßumbau in der Lunge von PH + Pz-Mäusen, was sich in einer Zunahme der Wandstärke und α-SMA-positiven Bereichen der Lungenarterien zeigte (Abb.
3
h–j). Darüber hinaus zeigten die Ergebnisse der Fluoreszenz-in-situ-Hybridisierung das Vorhandensein von P. zoogleoformans in den Lungen von PH + Pz-Mäusen, nicht jedoch in denen von PH-Mäusen (Abb.
3k
). Alle diese Daten zusammengenommen ergaben, dass die orale Inokulation von P. zoogleoformans die durch Hypoxie verursachte PH stark verschlimmerte.Abb. 3
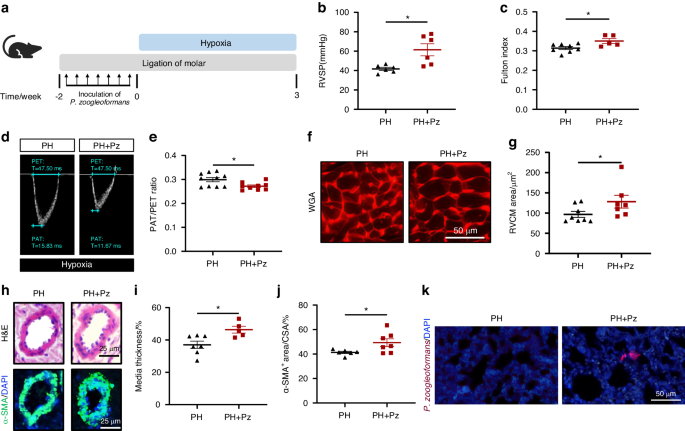 P. zoogleoformans verschlimmert den pH-Wert bei Mäusen. a Schematische Darstellung des Versuchsaufbaus. b , c RVSP b und Fulton-Index c , bestimmt durch das Verhältnis von (RV/(LV + S)). n = 6:6 für RVSP, n = 8:5 für den Fulton-Index. d , e Repräsentative Echokardiographiebilder d und Messungen der PA-Funktion anhand des PAT/PET-Verhältnisses e nach 3-wöchiger Hypoxie-Exposition. n = 10:9. f Repräsentative WGA-Färbung von RV-Schnitten. g Quantifizierung der RVCM-Fläche basierend auf WGA-Färbung. n = 8:7. h Repräsentative H&E-Färbung und Immunfluoreszenzfärbung von α-SMA von Lungenschnitten. i Quantifizierung der medialen Dicke als Prozentsatz des Außendurchmessers von PAs. n = 7:5. j Quantifizierung der α-SMA + -Fläche als Prozentsatz der Querschnittsfläche (CSA) von PAs. n = 6:7. k Fluoreszenz-in-situ-Hybridisierung für P. zoogleoformans in Lungenschnitten. Pz, ligaturinduzierte Parodontitis mit oraler Infektion von P. zoogleoformans . Die Daten werden als Mittelwert ± SEM dargestellt. Für die statistische Analyse wurde der Student- t -Test ( b , c , e , g , i , j ) verwendet. * P < 0,05
P. zoogleoformans erhöht die Akkumulation von Interferon-Gamma (IFNγ)-produzierenden T-ZellenEine fehlregulierte Immunantwort ist ein herausragendes pathologisches Kennzeichen der PH, die durch die überwältigende Infiltration von Immunzellen, einschließlich T-Lymphozyten, in das Lungengefäßsystem gekennzeichnet ist.
28
,
29
Um die zugrunde liegenden Mechanismen zu identifizieren, durch die P. zoogleoformans PH verschlimmert, konzentrierten wir uns auf die Profilierung von Immunzellen in der Lunge und den zervikalen Lymphknoten (cLNs) von PH- und PH + Pz-Mäusen 7 Tage nach der Hypoxiebehandlung mithilfe der Durchflusszytometrie . Es gab keine signifikante Veränderung in der Anzahl der gesamten CD4 + oder CD8 + T-Zellen zwischen den PH + Pz- und PH-Gruppen (Abb.
S5
a und
S5b
). Allerdings waren die Prozentsätze und Zahlen von CD4 + IFNγ + T-Zellen und CD8 + IFNγ + T-Zellen, nicht jedoch die von Interleukin-17A-positiven (IL17A + ) T-Zellen, in den Lungen in den PH + Pz-Gruppen im Vergleich zu PH deutlich erhöht Gruppen (Abb.
4
a–
d
,
S5
c und
S5d
). Darüber hinaus erhöhte die orale Inokulation von P. zoogleoformans die Anzahl der CD4 + IFNγ + T-Zellen in cLNs signifikant, während ihr Anteil unverändert blieb (Abb.
4
e, f). Die Anzahl der CD8 + IFNγ + T-Zellen war in cLNs zwischen der PH- und der PH + Pz-Gruppe vergleichbar, was darauf hindeutet, dass die Abnahme des relativen Anteils von CD8 + IFNγ + T-Zellen auf die Zunahme anderer Arten von Immunzellen zurückzuführen sein könnte (Abb .
4
g, h). Diese Ergebnisse zeigten zusammen, dass IFNγ + T-Zellen eine durch P. zoogleoformans induzierte Verschlimmerung der PH vermitteln könnten .Abb. 4
P. zoogleoformans verschlimmert den pH-Wert bei Mäusen. a Schematische Darstellung des Versuchsaufbaus. b , c RVSP b und Fulton-Index c , bestimmt durch das Verhältnis von (RV/(LV + S)). n = 6:6 für RVSP, n = 8:5 für den Fulton-Index. d , e Repräsentative Echokardiographiebilder d und Messungen der PA-Funktion anhand des PAT/PET-Verhältnisses e nach 3-wöchiger Hypoxie-Exposition. n = 10:9. f Repräsentative WGA-Färbung von RV-Schnitten. g Quantifizierung der RVCM-Fläche basierend auf WGA-Färbung. n = 8:7. h Repräsentative H&E-Färbung und Immunfluoreszenzfärbung von α-SMA von Lungenschnitten. i Quantifizierung der medialen Dicke als Prozentsatz des Außendurchmessers von PAs. n = 7:5. j Quantifizierung der α-SMA + -Fläche als Prozentsatz der Querschnittsfläche (CSA) von PAs. n = 6:7. k Fluoreszenz-in-situ-Hybridisierung für P. zoogleoformans in Lungenschnitten. Pz, ligaturinduzierte Parodontitis mit oraler Infektion von P. zoogleoformans . Die Daten werden als Mittelwert ± SEM dargestellt. Für die statistische Analyse wurde der Student- t -Test ( b , c , e , g , i , j ) verwendet. * P < 0,05
P. zoogleoformans erhöht die Akkumulation von Interferon-Gamma (IFNγ)-produzierenden T-ZellenEine fehlregulierte Immunantwort ist ein herausragendes pathologisches Kennzeichen der PH, die durch die überwältigende Infiltration von Immunzellen, einschließlich T-Lymphozyten, in das Lungengefäßsystem gekennzeichnet ist.
28
,
29
Um die zugrunde liegenden Mechanismen zu identifizieren, durch die P. zoogleoformans PH verschlimmert, konzentrierten wir uns auf die Profilierung von Immunzellen in der Lunge und den zervikalen Lymphknoten (cLNs) von PH- und PH + Pz-Mäusen 7 Tage nach der Hypoxiebehandlung mithilfe der Durchflusszytometrie . Es gab keine signifikante Veränderung in der Anzahl der gesamten CD4 + oder CD8 + T-Zellen zwischen den PH + Pz- und PH-Gruppen (Abb.
S5
a und
S5b
). Allerdings waren die Prozentsätze und Zahlen von CD4 + IFNγ + T-Zellen und CD8 + IFNγ + T-Zellen, nicht jedoch die von Interleukin-17A-positiven (IL17A + ) T-Zellen, in den Lungen in den PH + Pz-Gruppen im Vergleich zu PH deutlich erhöht Gruppen (Abb.
4
a–
d
,
S5
c und
S5d
). Darüber hinaus erhöhte die orale Inokulation von P. zoogleoformans die Anzahl der CD4 + IFNγ + T-Zellen in cLNs signifikant, während ihr Anteil unverändert blieb (Abb.
4
e, f). Die Anzahl der CD8 + IFNγ + T-Zellen war in cLNs zwischen der PH- und der PH + Pz-Gruppe vergleichbar, was darauf hindeutet, dass die Abnahme des relativen Anteils von CD8 + IFNγ + T-Zellen auf die Zunahme anderer Arten von Immunzellen zurückzuführen sein könnte (Abb .
4
g, h). Diese Ergebnisse zeigten zusammen, dass IFNγ + T-Zellen eine durch P. zoogleoformans induzierte Verschlimmerung der PH vermitteln könnten .Abb. 4
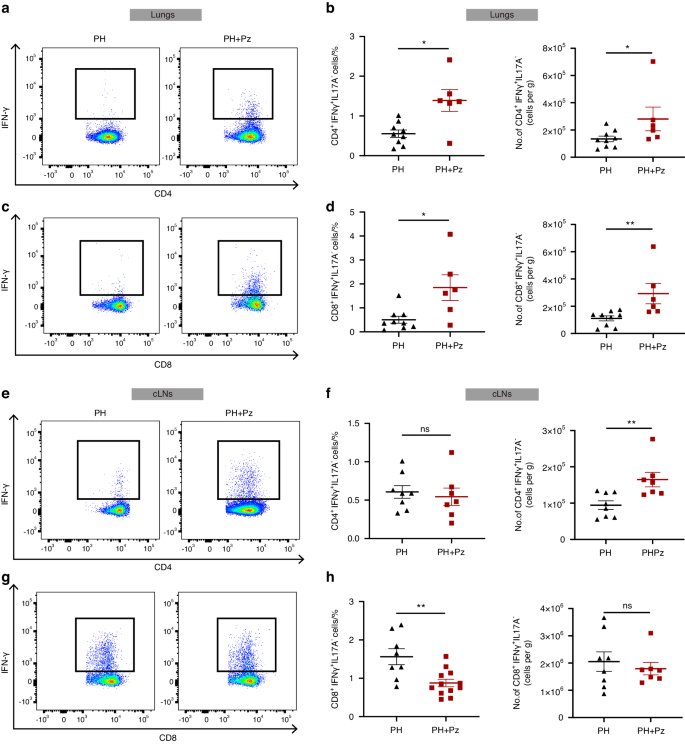 P. zoogleoformans fördert die Akkumulation von IFNγ + T-Zellen in der Lunge von Mäusen. Die Parodontitis wurde 14 Tage vor der PH-Einleitung durchgeführt. Die Proben wurden 7 Tage nach der PH-Induktion analysiert. a , b Repräsentative Durchflusszytometriediagramme von CD4 + IFNγ + T-Zellen a und Quantifizierung des Prozentsatzes von CD45 + -Zellen und der Anzahl von CD4 + IFNγ + T-Zellen b in der Lunge. n = 9:6. c , d Repräsentative Durchflusszytometriediagramme von CD8 + IFNγ + T-Zellen c und Quantifizierung des Prozentsatzes von CD45 + -Zellen und der Anzahl von CD8 + IFNγ + T-Zellen d in der Lunge. n = 9:6. e , f Repräsentative Durchflusszytometriediagramme von CD4 + IFNγ + T-Zellen e und Quantifizierung des Prozentsatzes von CD45 + -Zellen und der Anzahl von CD4 + IFNγ + T-Zellen f in zervikalen Lymphknoten (cLNs). n = 8:7. g , h Repräsentative Durchflusszytometriediagramme von CD8 + IFNγ + T-Zellen g und Quantifizierung des Prozentsatzes von CD45 + -Zellen und der Anzahl von CD8 + IFNγ + T-Zellen h in cLNs. n = 8:7. Die Daten werden als Mittelwert ± SEM dargestellt. Für die statistische Analyse wurde der Student- t- Test b , d , f , h verwendet. ns nicht signifikant. * P < 0,05. ** P < 0,01
Zervikale Lymphknoten sind entscheidend für die durch P. zoogleoformans verursachte Verschlimmerung der PHcLNs spielen eine entscheidende Rolle bei der Auslösung von Immunantworten auf pathogene Antigene in der Mundhöhle. Um ihre Rolle bei der durch P. zoogleoformans induzierten PH-Verschlimmerung aufzuklären, wurde bei Mäusen eine cLN-Exzision (CE) durchgeführt, gefolgt von der Ligation von Molaren und der Inokulation von P. zoogleoformans sowie der Induktion von Hypoxie (Abb.
5a
). CE hemmte den durch P. zoogleoformans induzierten Anstieg des RVSP- und Fulton-Index signifikant , hatte jedoch keine Wirkung auf PH-Mäuse (Abb.
5
b, c). Darüber hinaus wurde die Abnahme des PAT/PET-Verhältnisses durch cLN-Exzision umgekehrt (Abb.
5
d und
e
). Die Größe der Kardiomyozyten in der PH + Pz-Gruppe, jedoch nicht in der PH-Gruppe, wurde durch CE ebenfalls deutlich verringert, was auf eine Verbesserung der durch P. zoogleoformans verstärkten Hypertrophie des rechten Ventrikels hindeutet (Abb.
S6
a und
S6b
). Konsequenterweise wurde der Umbau der Lungenarterien nach der Entfernung von cLNs deutlich gemildert, wie die verringerte mediale Dicke und die kleinere α-SMA + -Fläche in der PH + Pz + CE-Gruppe im Vergleich zur PH + Pz-Gruppe zeigen (Abb.
5
f–h). CE konnte jedoch den Umbau der Lungenarterien bei PH-Mäusen nicht lindern (Abb.
5
f–h). Als nächstes untersuchten wir die Auswirkungen von CE auf die Infiltration von IFNγ + T-Zellen in der Lunge von PH + Pz-Mäusen mittels Durchflusszytometrie. Die Entfernung von cLNs unterdrückte die Ansammlung von CD4 + IFNγ + T-Zellen in der Lunge signifikant, während sie die Anzahl der CD8 + IFNγ + T-Zellen nicht beeinflusste (Abb.
4
a–d,
5
i–k,
S6
c und
S6d
). Dies weist darauf hin, dass die angereicherten CD4 + IFNγ + T-Zellen in der Lunge von cLNs in PH + Pz-Mäusen stammen. Diese Ergebnisse zeigten insgesamt, dass cLNs für die durch P. zoogleoformans induzierte Verschlimmerung der PH und den damit verbundenen Umbau von Herz und Gefäßen unverzichtbar waren .Abb. 5
P. zoogleoformans fördert die Akkumulation von IFNγ + T-Zellen in der Lunge von Mäusen. Die Parodontitis wurde 14 Tage vor der PH-Einleitung durchgeführt. Die Proben wurden 7 Tage nach der PH-Induktion analysiert. a , b Repräsentative Durchflusszytometriediagramme von CD4 + IFNγ + T-Zellen a und Quantifizierung des Prozentsatzes von CD45 + -Zellen und der Anzahl von CD4 + IFNγ + T-Zellen b in der Lunge. n = 9:6. c , d Repräsentative Durchflusszytometriediagramme von CD8 + IFNγ + T-Zellen c und Quantifizierung des Prozentsatzes von CD45 + -Zellen und der Anzahl von CD8 + IFNγ + T-Zellen d in der Lunge. n = 9:6. e , f Repräsentative Durchflusszytometriediagramme von CD4 + IFNγ + T-Zellen e und Quantifizierung des Prozentsatzes von CD45 + -Zellen und der Anzahl von CD4 + IFNγ + T-Zellen f in zervikalen Lymphknoten (cLNs). n = 8:7. g , h Repräsentative Durchflusszytometriediagramme von CD8 + IFNγ + T-Zellen g und Quantifizierung des Prozentsatzes von CD45 + -Zellen und der Anzahl von CD8 + IFNγ + T-Zellen h in cLNs. n = 8:7. Die Daten werden als Mittelwert ± SEM dargestellt. Für die statistische Analyse wurde der Student- t- Test b , d , f , h verwendet. ns nicht signifikant. * P < 0,05. ** P < 0,01
Zervikale Lymphknoten sind entscheidend für die durch P. zoogleoformans verursachte Verschlimmerung der PHcLNs spielen eine entscheidende Rolle bei der Auslösung von Immunantworten auf pathogene Antigene in der Mundhöhle. Um ihre Rolle bei der durch P. zoogleoformans induzierten PH-Verschlimmerung aufzuklären, wurde bei Mäusen eine cLN-Exzision (CE) durchgeführt, gefolgt von der Ligation von Molaren und der Inokulation von P. zoogleoformans sowie der Induktion von Hypoxie (Abb.
5a
). CE hemmte den durch P. zoogleoformans induzierten Anstieg des RVSP- und Fulton-Index signifikant , hatte jedoch keine Wirkung auf PH-Mäuse (Abb.
5
b, c). Darüber hinaus wurde die Abnahme des PAT/PET-Verhältnisses durch cLN-Exzision umgekehrt (Abb.
5
d und
e
). Die Größe der Kardiomyozyten in der PH + Pz-Gruppe, jedoch nicht in der PH-Gruppe, wurde durch CE ebenfalls deutlich verringert, was auf eine Verbesserung der durch P. zoogleoformans verstärkten Hypertrophie des rechten Ventrikels hindeutet (Abb.
S6
a und
S6b
). Konsequenterweise wurde der Umbau der Lungenarterien nach der Entfernung von cLNs deutlich gemildert, wie die verringerte mediale Dicke und die kleinere α-SMA + -Fläche in der PH + Pz + CE-Gruppe im Vergleich zur PH + Pz-Gruppe zeigen (Abb.
5
f–h). CE konnte jedoch den Umbau der Lungenarterien bei PH-Mäusen nicht lindern (Abb.
5
f–h). Als nächstes untersuchten wir die Auswirkungen von CE auf die Infiltration von IFNγ + T-Zellen in der Lunge von PH + Pz-Mäusen mittels Durchflusszytometrie. Die Entfernung von cLNs unterdrückte die Ansammlung von CD4 + IFNγ + T-Zellen in der Lunge signifikant, während sie die Anzahl der CD8 + IFNγ + T-Zellen nicht beeinflusste (Abb.
4
a–d,
5
i–k,
S6
c und
S6d
). Dies weist darauf hin, dass die angereicherten CD4 + IFNγ + T-Zellen in der Lunge von cLNs in PH + Pz-Mäusen stammen. Diese Ergebnisse zeigten insgesamt, dass cLNs für die durch P. zoogleoformans induzierte Verschlimmerung der PH und den damit verbundenen Umbau von Herz und Gefäßen unverzichtbar waren .Abb. 5
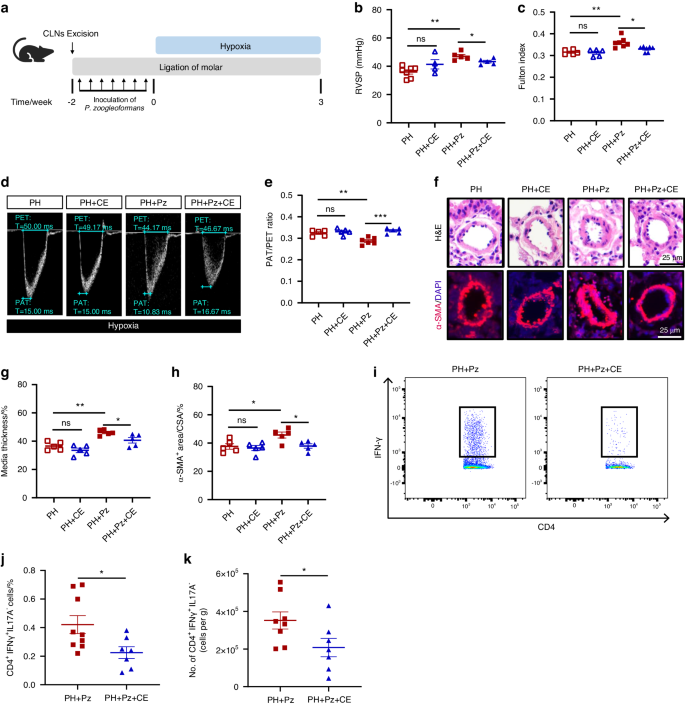 Die chirurgische Entfernung von cLNs lindert die verschlimmernden Auswirkungen von P. zoogleoformans auf PH. a Schematische Darstellung des Versuchsaufbaus. b , c RVSP b und c Fulton-Index, bestimmt durch das Verhältnis von (RV/(LV + S)). n = 5: 5:7:7 für RVSP, n = 7: 4:5:5 für den Fulton-Index. d , e Repräsentative Echokardiographiebilder d und Messungen der PA-Funktion anhand des PAT/PET-Verhältnisses e nach 3-wöchiger Hypoxie-Exposition. n = 5: 5:6:5. f Repräsentative H&E-Färbung und Immunfluoreszenzfärbung von α-SMA von Lungenschnitten. g Quantifizierung der medialen Dicke als Prozentsatz des Außendurchmessers von PAs. n = 5: 5:5:5. h Quantifizierung der α-SMA + -Fläche als Prozentsatz der Querschnittsfläche (CSA) von PAs. n = 5: 5:5:5. i Repräsentative Durchflusszytometriediagramme von CD4 + IFNγ + T-Zellen in der Lunge. j , k Quantifizierung des Prozentsatzes von CD45 + -Zellen und der Anzahl von CD4 + IFNγ + -T-Zellen in der Lunge. n = 8:7. CE, cLN-Exzision. Die Daten werden als Mittelwert ± SEM dargestellt. Für die statistische Analyse wurden die zweifaktorielle ANOVA b , c , e , g , h und der Student- t- Test j , k verwendet. ns nicht signifikant. * P < 0,05. ** P < 0,01. *** P < 0,001
Die IFNγ-Neutralisierung mildert den durch P. zoogleoformans verschlimmerten PHAls nächstes stellten wir fest, ob durch P. zoogleoformans induziertes IFNγ an der Verschlimmerung der PH beteiligt war. Zu diesem Zweck wurden Mäusen während der Hypoxie-Exposition alle drei Tage intraperitoneal IFNγ-neutralisierende Antikörper injiziert (Abb.
6a
). Die Neutralisierung von IFNγ verringerte RVSP und den Fulton-Index von PH-Mäusen und PH + Pz-Mäusen signifikant (Abb.
6
b, c). Darüber hinaus zeigte die Echokardiographie, dass die Neutralisierung von IFNγ das PAT/PET-Verhältnis bei PH-Mäusen verbesserte und die durch P. zoogleoformans induzierte Abnahme des PAT/PET-Verhältnisses umkehrte (Abb.
6
d, e). In ähnlicher Weise war die Kardiomyozyten-Hypertrophie von RV nach IFNγ-Neutralisierung in der PH-Gruppe und der PH + Pz-Gruppe signifikant reduziert, wie die Ergebnisse der WGA-Färbung zeigen (Abb.
6
f, g). Darüber hinaus verbesserte die Blockierung von IFNγ den Umbau der Lungengefäßwand bei PH-Mäusen und kehrte die durch P. zoogleoformans verursachte Verschlimmerung des Gefäßumbaus der Lungenarterien um, wie durch H&E- und α-SMA-Färbung gezeigt (Abb.
6
h–j). Somit kehrte die Neutralisierung von IFNγ die Auswirkungen von P. zoogleoformans auf die durch Hypoxie verursachte PH deutlich um, was die entscheidende Rolle von IFNγ unterstreicht.Abb. 6
Die chirurgische Entfernung von cLNs lindert die verschlimmernden Auswirkungen von P. zoogleoformans auf PH. a Schematische Darstellung des Versuchsaufbaus. b , c RVSP b und c Fulton-Index, bestimmt durch das Verhältnis von (RV/(LV + S)). n = 5: 5:7:7 für RVSP, n = 7: 4:5:5 für den Fulton-Index. d , e Repräsentative Echokardiographiebilder d und Messungen der PA-Funktion anhand des PAT/PET-Verhältnisses e nach 3-wöchiger Hypoxie-Exposition. n = 5: 5:6:5. f Repräsentative H&E-Färbung und Immunfluoreszenzfärbung von α-SMA von Lungenschnitten. g Quantifizierung der medialen Dicke als Prozentsatz des Außendurchmessers von PAs. n = 5: 5:5:5. h Quantifizierung der α-SMA + -Fläche als Prozentsatz der Querschnittsfläche (CSA) von PAs. n = 5: 5:5:5. i Repräsentative Durchflusszytometriediagramme von CD4 + IFNγ + T-Zellen in der Lunge. j , k Quantifizierung des Prozentsatzes von CD45 + -Zellen und der Anzahl von CD4 + IFNγ + -T-Zellen in der Lunge. n = 8:7. CE, cLN-Exzision. Die Daten werden als Mittelwert ± SEM dargestellt. Für die statistische Analyse wurden die zweifaktorielle ANOVA b , c , e , g , h und der Student- t- Test j , k verwendet. ns nicht signifikant. * P < 0,05. ** P < 0,01. *** P < 0,001
Die IFNγ-Neutralisierung mildert den durch P. zoogleoformans verschlimmerten PHAls nächstes stellten wir fest, ob durch P. zoogleoformans induziertes IFNγ an der Verschlimmerung der PH beteiligt war. Zu diesem Zweck wurden Mäusen während der Hypoxie-Exposition alle drei Tage intraperitoneal IFNγ-neutralisierende Antikörper injiziert (Abb.
6a
). Die Neutralisierung von IFNγ verringerte RVSP und den Fulton-Index von PH-Mäusen und PH + Pz-Mäusen signifikant (Abb.
6
b, c). Darüber hinaus zeigte die Echokardiographie, dass die Neutralisierung von IFNγ das PAT/PET-Verhältnis bei PH-Mäusen verbesserte und die durch P. zoogleoformans induzierte Abnahme des PAT/PET-Verhältnisses umkehrte (Abb.
6
d, e). In ähnlicher Weise war die Kardiomyozyten-Hypertrophie von RV nach IFNγ-Neutralisierung in der PH-Gruppe und der PH + Pz-Gruppe signifikant reduziert, wie die Ergebnisse der WGA-Färbung zeigen (Abb.
6
f, g). Darüber hinaus verbesserte die Blockierung von IFNγ den Umbau der Lungengefäßwand bei PH-Mäusen und kehrte die durch P. zoogleoformans verursachte Verschlimmerung des Gefäßumbaus der Lungenarterien um, wie durch H&E- und α-SMA-Färbung gezeigt (Abb.
6
h–j). Somit kehrte die Neutralisierung von IFNγ die Auswirkungen von P. zoogleoformans auf die durch Hypoxie verursachte PH deutlich um, was die entscheidende Rolle von IFNγ unterstreicht.Abb. 6
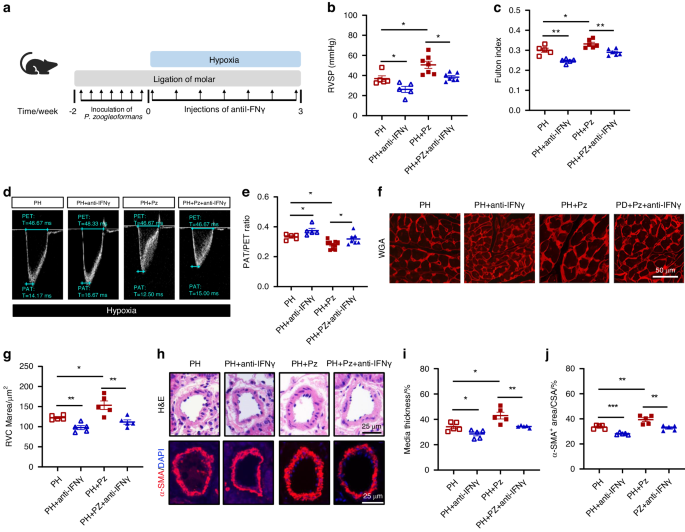 Die IFNγ-Neutralisierung schränkt P ein . Zoogleoformans -induzierte Verschlimmerung der PH. a Schematische Darstellung des Versuchsaufbaus. b , c RVSP b und c Fulton-Index, bestimmt durch das Verhältnis von (RV/(LV + S)). n = 5: 5:7:7 für RVSP, n = 5: 5:6:6 für den Fulton-Index. d , e Repräsentative Echokardiographiebilder d und Messungen der PA-Funktion anhand des PAT/PET-Verhältnisses e nach 3-wöchiger Hypoxie-Exposition. n = 5: 5:10:7. f Repräsentative WGA-Färbung von RV-Schnitten. g Quantifizierung der RVCM-Fläche basierend auf WGA-Färbung. n = 5:5:5:5. h Repräsentative H&E-Färbung und Immunfluoreszenzfärbung von α-SMA von Lungenschnitten. i Quantifizierung der medialen Dicke als Prozentsatz des Außendurchmessers von PAs. n = 5:5:5:5. j Quantifizierung der α-SMA + -Fläche als Prozentsatz der Querschnittsfläche (CSA) von PAs. n = 5:5:5:5. Anti-IFNγ- und IFNγ-neutralisierende Antikörperbehandlung. Die Daten werden als Mittelwert ± SEM dargestellt. Für die statistische Analyse wurde die Zwei-Wege-ANOVA b , c , e , g , i , j verwendet. * P < 0,05. ** P < 0,01. *** P < 0,001
DiskussionMehrere Studien haben gezeigt, dass die orale Mikrobiota die pulmonale Mikrobiota formen könnte, indem sie in die Lunge eindringt, was zu Lungenfunktionsstörungen und einem Anstieg proinflammatorischer Zytokine führt, die mit dem Fortschreiten der PH korrelieren.
18
,
24
,
30
Trotz dieser beobachteten Zusammenhänge gibt es einen bemerkenswerten Mangel an eindeutigen Beweisen, die einen Zusammenhang zwischen der oralen Mikrobiota und der Verschlechterung der PH herstellen. In dieser Studie wurde ein zusammengesetztes Mausmodell verwendet, das Parodontitis und PH berücksichtigte, und wir zeigten zum ersten Mal, dass Parodontitis das Fortschreiten der PH verschlimmerte. Mechanistisch gesehen förderte Parodontitis die ektopische Kolonisierung von P. zoogleoformans in der Lunge, was die Infiltration von IFNγ + T-Zellen hochregulierte und letztendlich den Schweregrad der PH verstärkte (Abb.
7
).Abb. 7
Die IFNγ-Neutralisierung schränkt P ein . Zoogleoformans -induzierte Verschlimmerung der PH. a Schematische Darstellung des Versuchsaufbaus. b , c RVSP b und c Fulton-Index, bestimmt durch das Verhältnis von (RV/(LV + S)). n = 5: 5:7:7 für RVSP, n = 5: 5:6:6 für den Fulton-Index. d , e Repräsentative Echokardiographiebilder d und Messungen der PA-Funktion anhand des PAT/PET-Verhältnisses e nach 3-wöchiger Hypoxie-Exposition. n = 5: 5:10:7. f Repräsentative WGA-Färbung von RV-Schnitten. g Quantifizierung der RVCM-Fläche basierend auf WGA-Färbung. n = 5:5:5:5. h Repräsentative H&E-Färbung und Immunfluoreszenzfärbung von α-SMA von Lungenschnitten. i Quantifizierung der medialen Dicke als Prozentsatz des Außendurchmessers von PAs. n = 5:5:5:5. j Quantifizierung der α-SMA + -Fläche als Prozentsatz der Querschnittsfläche (CSA) von PAs. n = 5:5:5:5. Anti-IFNγ- und IFNγ-neutralisierende Antikörperbehandlung. Die Daten werden als Mittelwert ± SEM dargestellt. Für die statistische Analyse wurde die Zwei-Wege-ANOVA b , c , e , g , i , j verwendet. * P < 0,05. ** P < 0,01. *** P < 0,001
DiskussionMehrere Studien haben gezeigt, dass die orale Mikrobiota die pulmonale Mikrobiota formen könnte, indem sie in die Lunge eindringt, was zu Lungenfunktionsstörungen und einem Anstieg proinflammatorischer Zytokine führt, die mit dem Fortschreiten der PH korrelieren.
18
,
24
,
30
Trotz dieser beobachteten Zusammenhänge gibt es einen bemerkenswerten Mangel an eindeutigen Beweisen, die einen Zusammenhang zwischen der oralen Mikrobiota und der Verschlechterung der PH herstellen. In dieser Studie wurde ein zusammengesetztes Mausmodell verwendet, das Parodontitis und PH berücksichtigte, und wir zeigten zum ersten Mal, dass Parodontitis das Fortschreiten der PH verschlimmerte. Mechanistisch gesehen förderte Parodontitis die ektopische Kolonisierung von P. zoogleoformans in der Lunge, was die Infiltration von IFNγ + T-Zellen hochregulierte und letztendlich den Schweregrad der PH verstärkte (Abb.
7
).Abb. 7
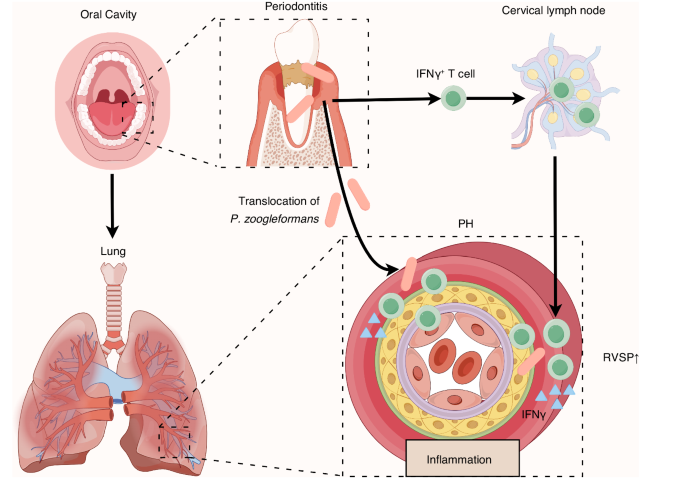 Arbeitsmodell zur Veranschaulichung der Mechanismen, die die Verschlimmerung der pulmonalen Hypertonie (PH) durch Parodontitis vermitteln. Parodontitis verschlimmert PH über eine Mund-Lungen-Achse. Zu den spezifischen Mechanismen gehören: (1) der orale Erreger P. zoogleoformans induziert die Expansion von IFNγ + T-Zellen in zervikalen Lymphknoten (cLNs) und (2) Parodontitis erleichtert die Translokation von P. zoogleoformans in die Lunge, was zu einer erhöhten Infiltration von führt IFNγ + T-Zellen in der Lunge. RVSP, rechtsventrikulärer systolischer Druck
Unsere Daten haben eindeutig gezeigt, dass Parodontitis das Fortschreiten der PH verschlimmert. In der aktuellen Studie haben wir uns auf die Rolle der Parodontitis, die eine paradigmatische Manifestation der oralen mikrobiellen Dysbiose darstellt, bei der Pathogenese der PH konzentriert. Wir beobachteten, dass Parodontitis die RV-Dysfunktion förderte und den Umbau der Lungenarterien bei durch Hypoxie verursachter PH verschlimmerte. PH ist eine Vaskulopathie, die durch übermäßige pulmonale Vasokonstriktion und abnormale Gefäßumbauprozesse gekennzeichnet ist, die eine unkontrollierte Proliferation von Endothel- und glatten Muskelzellen sowie Fibroblasten beinhalten.
3
,
24
Interessanterweise deuten Erkenntnisse aus epidemiologischen Studien darauf hin, dass Personen mit Parodontitis eine deutliche endotheliale Dysfunktion aufweisen, während eine parodontale Behandlung Ersatzmaße der endothelialen Funktion, wie z. B. eine flussvermittelte Erweiterung der Arteria brachialis, steigert.
31
,
32
Darüber hinaus haben zahlreiche klinische Studien gezeigt, dass hypertensive Personen mit Parodontitis einen erhöhten Blutdruck aufweisen und eine intensive parodontale Behandlung den Blutdruck deutlich senkt.
33
,
34
Obwohl berichtet wurde, dass Parodontitis die Gefäßfunktion beeinträchtigt, gibt es noch keine ausreichenden Belege, die die Rolle der Parodontitis bei PH klären.
35
Unsere Studie zeigte, dass Parodontitis die PH deutlich verschlimmerte, was auf einen direkten Zusammenhang zwischen Parodontitis und PH schließen lässt. Folglich ist eine angemessene Mundpflege, beispielsweise eine parodontale Behandlung, eine potenziell wirksame Strategie zur Behandlung der Komorbidität von Parodontitis und PH.Parodontitis verschlimmert die durch PH verursachte Dysbiose der Lungenmikrobiota über die Mund-Lungen-Achse weiter und trägt möglicherweise zur weiteren Verschlimmerung der PH bei. Es häufen sich Hinweise darauf, dass Veränderungen in der Mikrobiota der Atemwege entscheidende Auswirkungen auf das Fortschreiten der PH haben.
7
Unsere Ergebnisse zeigten, dass Parodontitis nicht nur die mikrobielle Vielfalt erhöhte, sondern auch die Zusammensetzung der Lungenmikrobiota während der PH veränderte. In Übereinstimmung mit einer früheren Studie war Ralstonia, eine Hauptgattung in Proben von Mikroorganismen des Oropharynx-Atemtrakts von PH-Patienten, auch die vorherrschende Gattung in Lungenproben der PH- und PH + PD-Gruppen in unserem Hypoxie-induzierten Mausmodell, was darauf hindeutet Das Hypoxie-induzierte Mausmodell könnte die Veränderungen in der Lungenmikrobiota von Patienten mit PH in gewissem Maße nachahmen.
10
Noch wichtiger ist, dass Parodontitis die Anreicherung oraler Bakterien in der Lunge förderte, darunter P. zoogleoformans . Diese Ergebnisse deuten darauf hin, dass Parodontitis die bereits bestehenden mikroökologischen Störungen im Zusammenhang mit PH weiter verschlimmern kann, indem sie die Verlagerung oraler Bakterien in die Lunge erleichtert. Dementsprechend zeigten frühere Erkenntnisse, dass Parodontitis nicht nur eine Dysbiose der oralen Mikrobiota auslösen kann, sondern auch distale Organe/Gewebe, einschließlich atherosklerotischer Plaques, Plazenta und Lunge, beeinträchtigen kann.
35
Parodontitis wurde auch mit Veränderungen der Darmmikrobiota bei Menschen und Mäusen in Verbindung gebracht.
36
,
37
Während das orale Mikrobiom als Faktor verschiedener Herz-Kreislauf-Erkrankungen anerkannt ist, wurde seinem Zusammenhang mit PH nur begrenzte Aufmerksamkeit geschenkt. Daher stärken unsere Daten den Beweis für die mikrobielle Kommunikation entlang der Mund-Lungen-Achse und unterstreichen deren Bedeutung für die Pathogenese von PH im Zusammenhang mit schlechter parodontaler Gesundheit.Parodontitis mit oraler Inokulation von P. zoogleoformans trägt zum Fortschreiten der Hypoxie-induzierten PH bei. Durch die Analyse der Mikrobiota in der Mundhöhle und der Lunge identifizierten wir das gramnegative Bakterium P. zoogleoformans als potenziellen Hauptverursacher der PH-Verschlimmerung. Weitere Experimente zeigten, dass die orale Inokulation von P. zoogleoformans die Reaktion auf chronische Hypoxie bei Mäusen verstärkte. Diese Ergebnisse unterstreichen die Bedeutung des oralen Bakteriums P. zoogleoformans , das wahrscheinlich durch ektopische Besiedlung der Lunge bei der Verschlimmerung von PH durch Parodontitis wirkt. Tatsächlich deuten frühere Erkenntnisse darauf hin, dass parodontale Pathobionten über den oro-pharyngealen Weg translozieren und die Lunge ektopisch besiedeln können.
22
,
38
Darüber hinaus können ektopisch besiedelte parodontale Krankheitserreger aus der Mundhöhle Immunreaktionen außerhalb der Mundhöhle modulieren und so zur Entwicklung systemischer Erkrankungen beitragen.
35
,
39
,
40
,
41
In ähnlicher Weise hat eine frühere Studie gezeigt, dass die Verabreichung von S. salivarius über die Atemwege bei Ratten eine experimentelle PH induziert, was auf Zusammenhänge zwischen der oralen Mikrobiota und der PH hinweist.
42
Die kombinierten Ergebnisse unserer Studie und früherer Forschungen zeigen, dass P. zoogleoformans aus der Ferne verbreitet werden und Immunreaktionen auslösen kann, die aktiv zu seinem pathogenen Potenzial beitragen. Angesichts der potenziellen pathogenen Rolle von P. zoogleoformans bei PH sind die gezielte Bekämpfung von P. zoogleoformans und die Verhinderung einer ektopischen Lungenbesiedlung vielversprechende Strategien für die Behandlung von PH als Komorbidität von Parodontitis.P. zoogleoformans mobilisierte während der PH vorwiegend IFNγ + T-Zellen. In der aktuellen Studie haben wir herausgefunden, dass die orale Inokulation von P. zoogleoformans die Infiltration von IFNγ + T-Zellen in die cLNs und die Lunge erleichtert. Durch die Entfernung von cLNs wurde der durch P. zoogleoformans verursachte Anstieg der pulmonalen Infiltration von IFNγ + T-Zellen, insbesondere CD4 + IFNγ + T-Zellen, aufgehoben, was darauf hindeutet, dass CD4 + IFNγ + T-Zellen von cLNs in die Lunge wandern können. Schließlich haben wir gezeigt, dass die Blockierung von IFNγ die Verschlimmerung der PH bei Mäusen nach Inokulation mit P. zoogleoformans wirksam begrenzte , was darauf hindeutet, dass P. zoogleoformans die PH auf IFNγ-abhängige Weise verschlimmerte. Frühere Studien haben gezeigt, dass das Ausschalten von IFNγ bei Mäusen die durch eine Pneumocystis- Infektion verursachte PH umkehrt,
43
was auf die entscheidende Rolle dieses Zytokins bei der Entwicklung von PH hinweist. Darüber hinaus wurden bei Patienten mit verschiedenen PH-Typen erhöhte IFNγ-Spiegel im Plasma und in der Lunge beobachtet, und eine seltene, aber äußerst schwerwiegende Nebenwirkung der klinischen Interferonbehandlung ist PH.
41
,
44
,
45
,
46
,
47
,
48
Angesichts dieser Erkenntnisse und unserer Ergebnisse kann gefolgert werden, dass die Blockierung von IFNγ für die Behandlung von PH von Vorteil ist.Insgesamt zeigten unsere Ergebnisse einen direkten Zusammenhang zwischen Parodontitis und PH. Mechanistisch gesehen ist das orale Bakterium P . Zoogleoformans förderten Lungenentzündungen und trugen anschließend über IFNγ zur Pathogenese von PH bei. Diese Ergebnisse legen nahe, dass die Bekämpfung von Parodontitis oder P. zoogleoformans vielversprechend ist, um die Präzision der PH-Behandlung zu verbessern, und dass IFNγ ein vielversprechendes therapeutisches Ziel von PH ist, insbesondere als Komorbidität von Parodontitis.
Arbeitsmodell zur Veranschaulichung der Mechanismen, die die Verschlimmerung der pulmonalen Hypertonie (PH) durch Parodontitis vermitteln. Parodontitis verschlimmert PH über eine Mund-Lungen-Achse. Zu den spezifischen Mechanismen gehören: (1) der orale Erreger P. zoogleoformans induziert die Expansion von IFNγ + T-Zellen in zervikalen Lymphknoten (cLNs) und (2) Parodontitis erleichtert die Translokation von P. zoogleoformans in die Lunge, was zu einer erhöhten Infiltration von führt IFNγ + T-Zellen in der Lunge. RVSP, rechtsventrikulärer systolischer Druck
Unsere Daten haben eindeutig gezeigt, dass Parodontitis das Fortschreiten der PH verschlimmert. In der aktuellen Studie haben wir uns auf die Rolle der Parodontitis, die eine paradigmatische Manifestation der oralen mikrobiellen Dysbiose darstellt, bei der Pathogenese der PH konzentriert. Wir beobachteten, dass Parodontitis die RV-Dysfunktion förderte und den Umbau der Lungenarterien bei durch Hypoxie verursachter PH verschlimmerte. PH ist eine Vaskulopathie, die durch übermäßige pulmonale Vasokonstriktion und abnormale Gefäßumbauprozesse gekennzeichnet ist, die eine unkontrollierte Proliferation von Endothel- und glatten Muskelzellen sowie Fibroblasten beinhalten.
3
,
24
Interessanterweise deuten Erkenntnisse aus epidemiologischen Studien darauf hin, dass Personen mit Parodontitis eine deutliche endotheliale Dysfunktion aufweisen, während eine parodontale Behandlung Ersatzmaße der endothelialen Funktion, wie z. B. eine flussvermittelte Erweiterung der Arteria brachialis, steigert.
31
,
32
Darüber hinaus haben zahlreiche klinische Studien gezeigt, dass hypertensive Personen mit Parodontitis einen erhöhten Blutdruck aufweisen und eine intensive parodontale Behandlung den Blutdruck deutlich senkt.
33
,
34
Obwohl berichtet wurde, dass Parodontitis die Gefäßfunktion beeinträchtigt, gibt es noch keine ausreichenden Belege, die die Rolle der Parodontitis bei PH klären.
35
Unsere Studie zeigte, dass Parodontitis die PH deutlich verschlimmerte, was auf einen direkten Zusammenhang zwischen Parodontitis und PH schließen lässt. Folglich ist eine angemessene Mundpflege, beispielsweise eine parodontale Behandlung, eine potenziell wirksame Strategie zur Behandlung der Komorbidität von Parodontitis und PH.Parodontitis verschlimmert die durch PH verursachte Dysbiose der Lungenmikrobiota über die Mund-Lungen-Achse weiter und trägt möglicherweise zur weiteren Verschlimmerung der PH bei. Es häufen sich Hinweise darauf, dass Veränderungen in der Mikrobiota der Atemwege entscheidende Auswirkungen auf das Fortschreiten der PH haben.
7
Unsere Ergebnisse zeigten, dass Parodontitis nicht nur die mikrobielle Vielfalt erhöhte, sondern auch die Zusammensetzung der Lungenmikrobiota während der PH veränderte. In Übereinstimmung mit einer früheren Studie war Ralstonia, eine Hauptgattung in Proben von Mikroorganismen des Oropharynx-Atemtrakts von PH-Patienten, auch die vorherrschende Gattung in Lungenproben der PH- und PH + PD-Gruppen in unserem Hypoxie-induzierten Mausmodell, was darauf hindeutet Das Hypoxie-induzierte Mausmodell könnte die Veränderungen in der Lungenmikrobiota von Patienten mit PH in gewissem Maße nachahmen.
10
Noch wichtiger ist, dass Parodontitis die Anreicherung oraler Bakterien in der Lunge förderte, darunter P. zoogleoformans . Diese Ergebnisse deuten darauf hin, dass Parodontitis die bereits bestehenden mikroökologischen Störungen im Zusammenhang mit PH weiter verschlimmern kann, indem sie die Verlagerung oraler Bakterien in die Lunge erleichtert. Dementsprechend zeigten frühere Erkenntnisse, dass Parodontitis nicht nur eine Dysbiose der oralen Mikrobiota auslösen kann, sondern auch distale Organe/Gewebe, einschließlich atherosklerotischer Plaques, Plazenta und Lunge, beeinträchtigen kann.
35
Parodontitis wurde auch mit Veränderungen der Darmmikrobiota bei Menschen und Mäusen in Verbindung gebracht.
36
,
37
Während das orale Mikrobiom als Faktor verschiedener Herz-Kreislauf-Erkrankungen anerkannt ist, wurde seinem Zusammenhang mit PH nur begrenzte Aufmerksamkeit geschenkt. Daher stärken unsere Daten den Beweis für die mikrobielle Kommunikation entlang der Mund-Lungen-Achse und unterstreichen deren Bedeutung für die Pathogenese von PH im Zusammenhang mit schlechter parodontaler Gesundheit.Parodontitis mit oraler Inokulation von P. zoogleoformans trägt zum Fortschreiten der Hypoxie-induzierten PH bei. Durch die Analyse der Mikrobiota in der Mundhöhle und der Lunge identifizierten wir das gramnegative Bakterium P. zoogleoformans als potenziellen Hauptverursacher der PH-Verschlimmerung. Weitere Experimente zeigten, dass die orale Inokulation von P. zoogleoformans die Reaktion auf chronische Hypoxie bei Mäusen verstärkte. Diese Ergebnisse unterstreichen die Bedeutung des oralen Bakteriums P. zoogleoformans , das wahrscheinlich durch ektopische Besiedlung der Lunge bei der Verschlimmerung von PH durch Parodontitis wirkt. Tatsächlich deuten frühere Erkenntnisse darauf hin, dass parodontale Pathobionten über den oro-pharyngealen Weg translozieren und die Lunge ektopisch besiedeln können.
22
,
38
Darüber hinaus können ektopisch besiedelte parodontale Krankheitserreger aus der Mundhöhle Immunreaktionen außerhalb der Mundhöhle modulieren und so zur Entwicklung systemischer Erkrankungen beitragen.
35
,
39
,
40
,
41
In ähnlicher Weise hat eine frühere Studie gezeigt, dass die Verabreichung von S. salivarius über die Atemwege bei Ratten eine experimentelle PH induziert, was auf Zusammenhänge zwischen der oralen Mikrobiota und der PH hinweist.
42
Die kombinierten Ergebnisse unserer Studie und früherer Forschungen zeigen, dass P. zoogleoformans aus der Ferne verbreitet werden und Immunreaktionen auslösen kann, die aktiv zu seinem pathogenen Potenzial beitragen. Angesichts der potenziellen pathogenen Rolle von P. zoogleoformans bei PH sind die gezielte Bekämpfung von P. zoogleoformans und die Verhinderung einer ektopischen Lungenbesiedlung vielversprechende Strategien für die Behandlung von PH als Komorbidität von Parodontitis.P. zoogleoformans mobilisierte während der PH vorwiegend IFNγ + T-Zellen. In der aktuellen Studie haben wir herausgefunden, dass die orale Inokulation von P. zoogleoformans die Infiltration von IFNγ + T-Zellen in die cLNs und die Lunge erleichtert. Durch die Entfernung von cLNs wurde der durch P. zoogleoformans verursachte Anstieg der pulmonalen Infiltration von IFNγ + T-Zellen, insbesondere CD4 + IFNγ + T-Zellen, aufgehoben, was darauf hindeutet, dass CD4 + IFNγ + T-Zellen von cLNs in die Lunge wandern können. Schließlich haben wir gezeigt, dass die Blockierung von IFNγ die Verschlimmerung der PH bei Mäusen nach Inokulation mit P. zoogleoformans wirksam begrenzte , was darauf hindeutet, dass P. zoogleoformans die PH auf IFNγ-abhängige Weise verschlimmerte. Frühere Studien haben gezeigt, dass das Ausschalten von IFNγ bei Mäusen die durch eine Pneumocystis- Infektion verursachte PH umkehrt,
43
was auf die entscheidende Rolle dieses Zytokins bei der Entwicklung von PH hinweist. Darüber hinaus wurden bei Patienten mit verschiedenen PH-Typen erhöhte IFNγ-Spiegel im Plasma und in der Lunge beobachtet, und eine seltene, aber äußerst schwerwiegende Nebenwirkung der klinischen Interferonbehandlung ist PH.
41
,
44
,
45
,
46
,
47
,
48
Angesichts dieser Erkenntnisse und unserer Ergebnisse kann gefolgert werden, dass die Blockierung von IFNγ für die Behandlung von PH von Vorteil ist.Insgesamt zeigten unsere Ergebnisse einen direkten Zusammenhang zwischen Parodontitis und PH. Mechanistisch gesehen ist das orale Bakterium P . Zoogleoformans förderten Lungenentzündungen und trugen anschließend über IFNγ zur Pathogenese von PH bei. Diese Ergebnisse legen nahe, dass die Bekämpfung von Parodontitis oder P. zoogleoformans vielversprechend ist, um die Präzision der PH-Behandlung zu verbessern, und dass IFNγ ein vielversprechendes therapeutisches Ziel von PH ist, insbesondere als Komorbidität von Parodontitis.
AbstraktDie Aufklärung der Risikofaktoren der pulmonalen Hypertonie und ihrer Mechanismen ist für die Prävention und Behandlung der Krankheit von entscheidender Bedeutung. In der aktuellen Studie haben wir gezeigt, dass eine experimentelle Parodontitis, die durch Unterbindung von Molaren und anschließendes orales Verschmieren subgingivaler Plaques von Patienten mit Parodontitis festgestellt wurde, die durch Hypoxie verursachte pulmonale Hypertonie bei Mäusen verschlimmerte. Mechanistisch führte die Parodontitis zu einer Fehlregulierung der pulmonalen Mikrobiota, indem sie die ektopische Kolonisierung und Anreicherung oraler Bakterien in der Lunge förderte, was zur pulmonalen Infiltration von Interferon-Gamma-positiven (IFNγ + ) T-Zellen beitrug und das Fortschreiten der pulmonalen Hypertonie verschlimmerte. Darüber hinaus identifizierten wir Prevotella zoogleoformans als das kritische Parodontitis-assoziierte Bakterium, das die Verschlimmerung der pulmonalen Hypertonie durch Parodontitis verursacht, und die Verschlimmerung wurde sowohl durch die Entfernung zervikaler Lymphknoten als auch durch neutralisierende IFNγ-Antikörper wirksam gelindert. Unsere Studie legt einen Proof of Concept nahe, dass die kombinierte Prävention und Behandlung von Parodontitis und pulmonaler Hypertonie notwendig sind.EinführungPulmonale Hypertonie (PH) ist nach wie vor eine ernste Erkrankung mit schlechter Prognose. 1 PH ist eine fortschreitende Erkrankung, die durch die allmähliche Zerstörung der Lungenarterien (PAs), erhöhten pulmonalarteriellen Druck sowie Hypertrophie und Umbau des rechten Ventrikels (RV) gekennzeichnet ist und in RV-Versagen und Tod gipfelt. 2 Zu den häufigen pathologischen Merkmalen gehören die Umgestaltung des distalen PA und die Infiltration von Entzündungszellen. 3 Begrenzte Behandlungsmöglichkeiten für PH verdeutlichen den dringenden Bedarf an mehr therapeutischen Zielen. 4 Es gibt immer mehr Hinweise darauf, dass es sich bei PH um eine systemische Erkrankung handelt, die von der Mikrobiota beeinflusst wird. 5 , 6 , 7 , 8 , 9 , 10 Darüber hinaus hat die Rolle der Darm-Lungen-Achse bei PH zunehmende Aufmerksamkeit erregt. 5 , 7 Zahlreiche Studien haben den Zusammenhang zwischen PH und dem Magen-Darm-Trakt untersucht und dabei eine proinflammatorische Darmmikrobiota und veränderte mikrobielle Metaboliten bei Personen mit PH aufgedeckt. 11 , 12 , 13 , 14 Darüber hinaus verzögert der Abbau der Darmmikrobiota durch Antibiotikaeingriffe die PH-Entwicklung in einem Rattenmodell. 15 Andererseits hat die Bedeutung der Mund-Lungen-Achse bei Atemwegserkrankungen an Bedeutung gewonnen. Es wird vermutet, dass der Mundgesundheitszustand ein entscheidender Faktor für die Lungengesundheit ist, da die Mikroben aus der Mundhöhle nach dem Einatmen in die unteren Atemwege Atemwegsinfektionen und Entzündungen auslösen können. 16 , 17 , 18 Darüber hinaus wurden Zusammenhänge zwischen oraler Dysbiose, insbesondere Parodontitis, und verschiedenen Atemwegserkrankungen beobachtet. 17 , 19 , 20 Die spezifische Rolle der oralen Mikrobiota bei der Aufrechterhaltung der Lungenhomöostase während PH bleibt jedoch weitgehend unerforscht.Parodontitis dient als paradigmatisches Beispiel für ein orales mikroökologisches Ungleichgewicht mit epidemiologischen Verbindungen zu verschiedenen systemischen Erkrankungen, einschließlich Infektionen der Atemwege. 21 Der Zusammenhang zwischen Parodontitis und systemischen Komorbiditäten wird häufig durch lokale und systemische Immunreaktionen auf orale Krankheitserreger vermittelt. 22 Darüber hinaus gibt es substanzielle Hinweise darauf, dass Entzündungen eine Schlüsselrolle bei menschlicher und experimenteller PH spielen. 23 In umgestalteten Lungenarterien bei Patienten mit PH wird eine Infiltration von Immunzellen beobachtet, an der hauptsächlich T- und B-Lymphozyten, Makrophagen, Monozyten, Mastzellen und dendritische Zellen beteiligt sind. 24 , 25 Darüber hinaus wurden in Tiermodellen und bei Patienten mit PH hohe Konzentrationen an Zytokinen, Chemokinen und Autoantikörpern festgestellt, was auf lokale adaptive Immunantworten in der Lunge schließen lässt. 25 , 26 Daher könnte die Erforschung der Wechselwirkung zwischen der oralen Mikrobiota und der Immunität bei PH neue therapeutische Erkenntnisse für die Behandlung von PH liefern.Unser Hauptziel in dieser Studie war es, den kausalen Zusammenhang zwischen Parodontitis und PH zu untersuchen und die zugrunde liegenden Mechanismen zu identifizieren. Zunächst verwendeten wir ein zusammengesetztes Mausmodell, das ein experimentelles Parodontitismodell mit einer durch Hypoxie induzierten PH kombinierte, um den Einfluss von Parodontitis auf die PH zu untersuchen. Anschließend führten wir eine umfassende Analyse der Mund- und Lungenmikrobiota durch, um die zentralen oralen Mikroben zu identifizieren, die am Einfluss der Parodontitis auf das pathologische Fortschreiten der PH beteiligt sind. Als nächstes untersuchten wir die Auswirkungen oraler Mikroben auf die Immunantwort während PH. Schließlich wurden neutralisierende Antikörper verwendet, um zu beurteilen, ob die Immunantwort die Wirkung oraler Mikroben auf die Verschlimmerung der PH vermittelte.ErgebnisseParodontitis verschlimmert den durch Hypoxie verursachten PH bei MäusenUm den Einfluss der Parodontitis auf das Fortschreiten der PH bei Mäusen zu untersuchen, haben wir ein Maus-Parodontitis-Modell erstellt, indem wir die bilateralen zweiten Molaren des Oberkiefers mit Seidennaht abgebunden und subgingivale Plaques von Parodontitis-Patienten zwei Wochen lang verschmiert haben (das zusammengesetzte Modell wurde als PD bezeichnet). . Anschließend wurden die Mäuse 3 Wochen lang einer Hypoxie ausgesetzt, um PH zu induzieren (Abb. 1a ). Wie erwartet führte Parodontitis bei Mäusen unter normoxischen und hypoxischen Bedingungen zu einem erheblichen Alveolarknochenverlust (Abb. S1 a und S1b ). Eine erhöhte RV-Nachlast ist eine Folge eines erhöhten Lungenkreislaufdrucks, der schließlich zu RV-Hypertrophie und Dysfunktion führt. 27 Mäuse in der PH + PD-Gruppe zeigten im Vergleich zu Mäusen in der PH-Gruppe einen signifikanten Anstieg des rechtsventrikulären systolischen Drucks (RVSP) und des Fulton-Index, zwei Marker für RV-Hypertrophie (Abb. 1 b, c). Bei Mäusen ohne PH hatte Parodontitis jedoch keinen Einfluss auf RVSP oder Fulton-Index (Abb. 1 b, c). Eine Verringerung des Verhältnisses von Lungenarterienbeschleunigung zu Auswurfzeit (PAT/PET) weist häufig auf eine beeinträchtigte Lungengefäßfunktion bei PH-Mäusen hin. Die Echokardiographie zeigte ein geringeres PAT/PET-Verhältnis bei PH + PD-Mäusen als bei PH-Mäusen, es wurde jedoch kein Unterschied zwischen PD-Mäusen und Ctrl-Mäusen beobachtet (Abb. 1 d, e). Um die Kardiomyozytenhypertrophie des rechten Ventrikels zu bewerten, führten wir eine Weizenkeimagglutinin (WGA)-Färbung von Mausherzschnitten durch. Die Ergebnisse zeigten eine größere Kardiomyozytengröße bei PH + PD-Mäusen im Vergleich zu PH-Mäusen (Abb. 1 f, g). Darüber hinaus zeigten die Hämatoxylin- und Eosin-Färbung (H&E) (Abb. 1 h, i) und die Immunfluoreszenzfärbung von Lungenschnitten (Abb. 1 j, k) deutlich verdickte mediale Wände und einen Anstieg der α-Glattmuskel-Aktin-Positivität (α-SMA). + ) Bereiche in distalen PAs von PH + PD-Mäusen im Vergleich zu PH-Mäusen, was auf einen stärkeren Gefäßumbau der Lungenarterie bei PH + PD-Mäusen als bei PH-Mäusen hindeutet. Insgesamt zeigten unsere Daten, dass Parodontitis das Fortschreiten der durch Hypoxie verursachten PH verschlimmerte.Abb. 1







OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
Bitte Anmelden oder Registrieren um der Konversation beizutreten.
