- Beiträge: 1751
Sidebar
Monozytenphänomen in großer Höhe bei PH
10 Dez 2023 22:51 #1955
von danny
OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
Monozytenphänomen in großer Höhe bei PH wurde erstellt von danny
www.nature.com/articles/s41467-023-37527-4Die Einzelzellanalyse des peripheren Blutes von Patienten mit pulmonaler Hypertonie in großer Höhe identifiziert einen ausgeprägten Monozyten-Phänotyp AbstraktImmun- und Entzündungsreaktionen spielen eine wichtige Rolle in der Pathophysiologie der pulmonalen Hypertonie (PH). Über die Immunlandschaft im peripheren Kreislauf bei Patienten mit pulmonaler Hypertonie in großer Höhe (HAPH) ist jedoch wenig bekannt. Wir verwenden Einzelzelltranskriptomik, um die Monozyten zu charakterisieren, die in den mononukleären Zellen des peripheren Blutes (PBMC) von HAPH-Patienten signifikant angereichert sind. Wir entdecken einen Anstieg der C1-Monozyten (nicht-klassisch) und C2-Monozyten (intermediär) in PBMCs und eine Abnahme des Hypoxie-induzierbaren Transkriptionsfaktors 1α (HIF-1α) in allen mit HAPH assoziierten Monozyten-Untergruppen. Darüber hinaus zeigen wir, dass bei HAPH und PH ähnliche Immunanpassungen existieren können. Insgesamt charakterisieren wir einen Immunzellatlas des peripheren Blutes bei HAPH-Patienten. Unsere Daten liefern Hinweise darauf, dass bestimmte Monozyten-Untergruppen und die Herunterregulierung von HIF-1α an der Pathogenese von HAPH beteiligt sein könnten.Ähnliche Inhalte werden von anderen angezeigt
Einzelzell-Transkriptomprofil menschlicher Lungenarterien-Endothelzellen bei Gesundheit und pulmonaler arterieller Hypertonie
Artikel Open Access19. Juli 2021
Die transkriptionellen und phänotypischen Merkmale, die Alveolarmakrophagen-Untergruppen bei akutem hypoxämischem Atemversagen definieren
Artikel Open Access17. November 2023
Eine transkriptomweite Analyse bringt die ID2-Expression mit einer kombinierten prä- und postkapillären pulmonalen Hypertonie in Verbindung
Artikel Open Access20. Dezember 2019EinführungPulmonale Hypertonie (PH) umfasst eine Gruppe schwerer klinischer Erkrankungen, die ursprünglich durch einen mittleren pulmonalen arteriellen Ruhedruck (mPAP) von 20 mm Hg oder mehr definiert
wurden
. Es wurde eine aktualisierte klinische Klassifikation der PH erstellt, in der die Weltgesundheitsorganisation (WHO) die PH in fünf Gruppen von Erkrankungen mit ähnlichen pathologischen und hämodynamischen Merkmalen einteilte: Gruppe 1 – pulmonale arterielle Hypertonie (PAH), Gruppe 2 – PH aufgrund des linken Herzens Krankheit, Gruppe 3 – PH aufgrund von Lungenerkrankungen und/oder Hypoxie; Gruppe 4 – chronische thromboembolische PH und andere Lungenarterienobstruktionen und Gruppe 5 – PH mit unklaren und/oder multifaktoriellen Mechanismen
2
.Die pulmonale Hypertonie in großer Höhe (HAPH) gehört zur dritten PH-Kategorie, von der Bevölkerungsgruppen betroffen sind, die in Höhen über 2500 Metern leben. HAPH ist in hochgelegenen Gebieten der Welt zu einem Problem für die öffentliche Gesundheit geworden, darunter im kirgisischen Hochland, in Äthiopien, in den Andenregionen und auf dem Qinghai-Tibet-Plateau in China
3
,
4
. Trotz der Verfügbarkeit mehrerer Behandlungsstrategien, die auf die Endothelin-, Stickoxid- und Prostacyclin-Wege abzielen, können diese Medikamente nur dazu beitragen, die Symptome zu lindern und das Fortschreiten der PH zu verlangsamen
3
,
5
,
6
.Es wird zunehmend anerkannt, dass es sich bei PH um eine fortschreitende Gefäßerkrankung handelt, die auf eine Vielzahl pathologischer Prozesse zurückzuführen ist, wie z. B. Ansammlung von Gefäßzellen, endotheliale Dysfunktion, Proliferation glatter Muskelzellen, epigenetische Veränderungen, metabolische Umprogrammierung und perivaskuläre Entzündungen
7
,
8
,
9
. Allerdings sind die Mechanismen, die HAPH zugrunde liegen, weniger gut verstanden. Eine frühere Untersuchung zeigte, dass zu den pathogenen Faktoren, die zum Fortschreiten der HAPH beitragen, Hypoxie, Vaskulopathie, Stickstoffmonoxid (NO)-Synthese und Stoffwechselstörungen gehören können
6
,
10
. Insbesondere können die hypoxischen Reize großer Höhen eine pulmonale Vasokonstriktion auslösen und den pulmonalen arteriellen Druck (PAP) erhöhen
6
, und Hypoxie-induzierbare Transkriptionsfaktoren (HIFs) sind an der Pathophysiologie des Lungengefäßumbaus beteiligt
11
,
12
,
13
. Darüber hinaus zeigte eine kürzlich durchgeführte experimentelle Studie, dass nichtklassische Monozyten im Lungengewebe von Mäusen Hypoxie wahrnehmen, kleine Lungenarterien infiltrieren und PH
14
fördern können . Da es keine zuverlässige Methode zur Gewinnung von Lungengewebe bei PH-Patienten gibt, wurden Untersuchungen der Mechanismen, die zum Fortschreiten der Krankheit beitragen, behindert. Kürzlich wurden funktionelle genomische oder proteomische Hochdurchsatzansätze auf periphere Blutproben angewendet, um die PH-Pathobiologie zu untersuchen
15
,
16
. Metaanalysen der Blutexpressionsprofile bei PH deuteten auf gemeinsame immunologische Veränderungen mit ihren vergleichbaren Histopathologien hin
15
,
17
. Zusammengenommen deuten diese Studien darauf hin, dass eine anhaltend fehlregulierte Immunantwort zur Entstehung oder Progression von PH beitragen kann. Bisher war jedoch wenig über das gesamte genomweite Expressionsprofil von mononukleären Zellen des peripheren Blutes (PBMCs) und die zirkulierende Immunantwort von HAPH-Patienten bekannt.Hier zeigen wir, dass HAPH-Patienten im Vergleich zu Kontrollen einen signifikanten Anstieg der Häufigkeit spezifischer Monozyten-Untergruppen in PBMCs aufweisen. Darüber hinaus leiden HAPH-Patienten möglicherweise an einer Beeinträchtigung der HIF-1α-Signalübertragung in den Monozyten des Blutes, die eine andere Gensignatur als die Kontrollpersonen aufweisen. Gemeinsam stellen wir einen Zellatlas der zirkulierenden Immunantwort bei HAPH-Patienten dar und heben einen möglichen Zusammenhang zwischen peripheren Monozyten und der Pathophysiologie von HAPH hervor.ErgebnisseEinzelzell-RNA-Profilierung von PBMCs bei HAPH-Patienten und gesunden KontrollpersonenIn diese Studie wurden 6 PH-Patienten aufgenommen, die in 45 m Höhe lebten, 11 HAPH-Patienten und 15 zeitgenössische Personen, die in 2900–3100 m Höhe lebten (Abb.
1
). Es gab keine Unterschiede zwischen den drei Gruppen in Bezug auf Blutdruck, Herzfrequenz, Cholesterin oder Leber- und Nierenfunktion. Der sPAP war bei PH-Patienten höher als bei HAPH-Patienten (86,5 ± 16,0 mmHg vs. 50,0 ± 9,8 mmHg, p < 0,05) und beide Gruppen hatten einen höheren sPAP als die Kontrollen mit einem durchschnittlichen sPAP von 10,9 ± 4,4 mmHg (beide p < 0,05). ) (Tabelle
1
). Um die mit HAPH verbundenen zirkulierenden immunologischen Veränderungen zu analysieren, führten wir eine scRNA-Seq an Immunzellen durch, die von 7 HAPH-Patienten und 5 gesunden Kontrollpersonen isoliert wurden (Abb.
1
). Wir bewerteten durchschnittlich 5733 Zellen pro Probe, wobei im Mittel 1204 Gene pro Zelle nachgewiesen wurden.Abb. 1: Flussdiagramm des Studiendesigns.
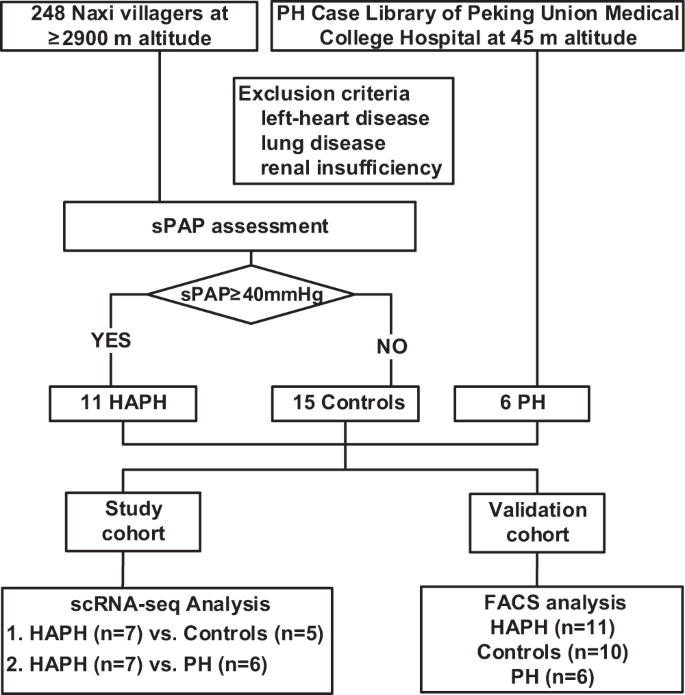 Insgesamt wurden 11 Patienten mit sPAP ≥40 mmHg und 15 Kontrollpersonen, die auf einer Höhe von ≥2900 m lebten, und 6 PH-Fälle, die auf einer Höhe von 45 m lebten, eingeschlossen. Eine scRNA-seq-Analyse wurde im Vergleich zwischen 7 HAPH und 5 Kontrollen sowie zwischen 7 HAPH und 6 PH durchgeführt, gefolgt von einer Validierung zwischen 6 PH, 11 HAPH und 10 Kontrollen mit FACS-Analyse. PH pulmonale Hypertonie, HAPH pulmonale Hypertonie in großer Höhe, sPAP systolischer Lungenarteriendruck, scRNA-seq-Einzelzell-RNA-Sequenzierung, FACS-Fluoreszenz-aktivierte Zellsortierung.
Tabelle 1 Merkmale der Studienteilnehmer
Unterschiedliche Immunzellzusammensetzungen in PBMCs zwischen HAPH-Patienten und gesunden KontrollpersonenUm die Immunlandschaft und ihre Assoziation mit HAPH zu charakterisieren, wurde eine unbeaufsichtigte Clusterbildung der Zellen durchgeführt (ergänzende Abbildungen
1
und
2
). In allen Proben identifizierten wir 9 Hauptzelltypen, bestehend aus T-Zellen (z. B. CD4 + T-Zellen, CD8 + T-Zellen und regulatorische T-Zellen), B-Zellen (z. B. B-Zellen, Gedächtnis-B-Zellen und naive B-Zellen). , Monozyten, NK-Zellen und hämatopoetische Stammzellen (HSCs) gemäß den kanonischen Genmarker-Expressionen (Abb.
2a, b
). Wir konnten auch einige dendritische Zellen mit dem klassischen Markergen CD1C identifizieren (ergänzende Abbildung
3
). Beim Vergleich der Clusterzusammensetzungen zwischen den beiden Gruppen stellten wir fest, dass Cluster 16 (Monozyten) bei den HAPH-Patienten angereichert war ( p < 0,05, zweiseitiger Wilcoxon-Rangsummentest) und Cluster 18 (NK-Zellen) und Cluster 21 ( CD4 + T-Zellen) waren in den Kontrollproben häufiger ( p <0, 05 für alle Vergleiche, zweiseitiger Wilcoxon-Rangsummentest) (Ergänzende Abbildung
2a, b
). Als nächstes analysierten wir die relativen Prozentsätze der oben genannten Hauptzelltypen in beiden Gruppen. Es stellte sich heraus, dass bei den HAPH-Patienten nur Monozyten signifikant angereichert waren ( p < 0,05, zweiseitiger Wilcoxon-Rang-Summen-Test) (Abb.
2c, d
). Die relative Häufigkeit von NK-Zellen war in den Kontrollproben tendenziell angereichert, obwohl die Unterschiede keine statistische Signifikanz erreichten (Abb.
2c, d
). Um die Natur der Immunprofile besser zu verstehen, validierten wir T-Zellen und NK-Zellen mittels Durchflusszytometrie mit klassischen Markern für das Zell-Gating. Die Häufigkeit von Immunsubpopulationen in PBMCs ist in der ergänzenden Abbildung
2c
(Ergänzungstabelle
1
) dargestellt. Diese Beobachtungen legen nahe, dass bei Patienten mit HAPH eine fehlregulierte Entzündungsreaktion auftreten kann.Abb. 2: Unterschiedliche Zusammensetzung der Immunzellen im Kreislauf von Patienten mit HAPH.
Insgesamt wurden 11 Patienten mit sPAP ≥40 mmHg und 15 Kontrollpersonen, die auf einer Höhe von ≥2900 m lebten, und 6 PH-Fälle, die auf einer Höhe von 45 m lebten, eingeschlossen. Eine scRNA-seq-Analyse wurde im Vergleich zwischen 7 HAPH und 5 Kontrollen sowie zwischen 7 HAPH und 6 PH durchgeführt, gefolgt von einer Validierung zwischen 6 PH, 11 HAPH und 10 Kontrollen mit FACS-Analyse. PH pulmonale Hypertonie, HAPH pulmonale Hypertonie in großer Höhe, sPAP systolischer Lungenarteriendruck, scRNA-seq-Einzelzell-RNA-Sequenzierung, FACS-Fluoreszenz-aktivierte Zellsortierung.
Tabelle 1 Merkmale der Studienteilnehmer
Unterschiedliche Immunzellzusammensetzungen in PBMCs zwischen HAPH-Patienten und gesunden KontrollpersonenUm die Immunlandschaft und ihre Assoziation mit HAPH zu charakterisieren, wurde eine unbeaufsichtigte Clusterbildung der Zellen durchgeführt (ergänzende Abbildungen
1
und
2
). In allen Proben identifizierten wir 9 Hauptzelltypen, bestehend aus T-Zellen (z. B. CD4 + T-Zellen, CD8 + T-Zellen und regulatorische T-Zellen), B-Zellen (z. B. B-Zellen, Gedächtnis-B-Zellen und naive B-Zellen). , Monozyten, NK-Zellen und hämatopoetische Stammzellen (HSCs) gemäß den kanonischen Genmarker-Expressionen (Abb.
2a, b
). Wir konnten auch einige dendritische Zellen mit dem klassischen Markergen CD1C identifizieren (ergänzende Abbildung
3
). Beim Vergleich der Clusterzusammensetzungen zwischen den beiden Gruppen stellten wir fest, dass Cluster 16 (Monozyten) bei den HAPH-Patienten angereichert war ( p < 0,05, zweiseitiger Wilcoxon-Rangsummentest) und Cluster 18 (NK-Zellen) und Cluster 21 ( CD4 + T-Zellen) waren in den Kontrollproben häufiger ( p <0, 05 für alle Vergleiche, zweiseitiger Wilcoxon-Rangsummentest) (Ergänzende Abbildung
2a, b
). Als nächstes analysierten wir die relativen Prozentsätze der oben genannten Hauptzelltypen in beiden Gruppen. Es stellte sich heraus, dass bei den HAPH-Patienten nur Monozyten signifikant angereichert waren ( p < 0,05, zweiseitiger Wilcoxon-Rang-Summen-Test) (Abb.
2c, d
). Die relative Häufigkeit von NK-Zellen war in den Kontrollproben tendenziell angereichert, obwohl die Unterschiede keine statistische Signifikanz erreichten (Abb.
2c, d
). Um die Natur der Immunprofile besser zu verstehen, validierten wir T-Zellen und NK-Zellen mittels Durchflusszytometrie mit klassischen Markern für das Zell-Gating. Die Häufigkeit von Immunsubpopulationen in PBMCs ist in der ergänzenden Abbildung
2c
(Ergänzungstabelle
1
) dargestellt. Diese Beobachtungen legen nahe, dass bei Patienten mit HAPH eine fehlregulierte Entzündungsreaktion auftreten kann.Abb. 2: Unterschiedliche Zusammensetzung der Immunzellen im Kreislauf von Patienten mit HAPH.
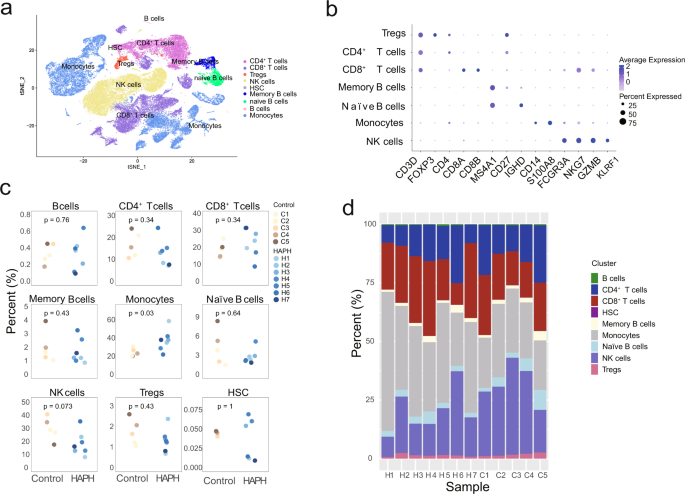 ein t-SNE-Diagramm der wichtigsten Untergruppen der Immunzellen. b Punktdiagramm, das die Prozentsätze und durchschnittlichen Expressionen der kanonischen Gene darstellt, die mit jedem Hauptimmunzellcluster assoziiert sind. c Boxplots, die die Prozentsätze der angegebenen Zelltypen in PBMCs zwischen HAPH-Patienten ( n = 7) und Kontrollteilnehmern ( n = 5) vergleichen. Dargestellt sind die zweiseitigen p- Werte aus dem Wilcoxon-Rangsummentest. d Anteile jedes Zelltyps bei HAPH-Patienten ( n = 7) und Kontrollteilnehmern ( n = 5). HAPH pulmonale Hypertonie in großer Höhe, t-SNE t-verteilte stochastische Nachbareinbettung, PBMCs mononukleäre Zellen des peripheren Blutes.
Definition von Monozyten-Untergruppen und deren Assoziationen mit HAPHMenschliche Monozyten bestehen aus phänotypisch und funktionell unterschiedlichen Subpopulationen
18
. Frühere Studien haben auf einen entscheidenden Beitrag von Monozyten zur Pathophysiologie von PH hingewiesen
14
,
19
,
20
. Aufgrund der hohen Häufigkeit von Monozyten und ihrer Assoziation mit HAPH haben wir unsere Analyse daher auf Monozyten konzentriert. Bei allen Monozyten wurde eine unbeaufsichtigte Clusterbildung durchgeführt, wobei drei Hauptsubcluster identifiziert wurden: die Monozyten C0, C1 und C2 (Abb.
3a – c
). Die unterschiedlich exprimierten Genlisten sind in der Ergänzungstabelle
2
für C0, C1 bzw. C2 aufgeführt. Monozyten-C0-Zellen exprimierten die klassischen Monozytenmarker CD14, Phospholipase-B-Domäne enthaltend 1 (PLBD1), die proinflammatorischen Mediatoren S100-Calcium-Bindungsprotein A2 (S100A12) und S100A8, während das Fc-Fragment des IgG-Rezeptors IIIa (FCGR3A)/CD16 vorhanden war selten exprimiert (Abb.
3d
), was der Hauptpopulation von Monozyten, den klassischen (CD14 + CD16 - ) Monozyten
18
,
21
,
22,
ähnelte . Monozyten-C1-Zellen exprimierten die höchste Konzentration an FCGR3A/CD16 und mittlere Konzentrationen an CD14, mit einer Hochregulierung des Ras-Homolog-Genfamilienmitglieds C (RHOC), der Hämoxygenase 1 (HMOX1), der Kinasen der Src-Familie, die die hämopoetische Zellkinase (HCK) bilden, und Tyrosin Proteinkinase Lyn (LYN) und Komplementkomponente 1 q Unterkomponente-α-Polypeptid (C1QA) (Abb.
3d
). Die RNA-Expressionsprofile von Monozyten-C1-Zellen ähnelten denen von nicht-klassischen (z. B. CD14 - CD16 + ) Monozyten, wie zuvor berichtet
22
,
23
. Während Monozyten-C2-Zellen relativ geringere Expressionen von FCGR3A/CD16 zeigten (Abb.
3d ), die denen von intermediären (z. B. CD14
- CD16 - ) Monozyten ähnelten
21
,
23
.Abb. 3: Ausbreitung von Monozytenclustern im Kreislaufsystem von Patienten mit HAPH.
ein t-SNE-Diagramm der wichtigsten Untergruppen der Immunzellen. b Punktdiagramm, das die Prozentsätze und durchschnittlichen Expressionen der kanonischen Gene darstellt, die mit jedem Hauptimmunzellcluster assoziiert sind. c Boxplots, die die Prozentsätze der angegebenen Zelltypen in PBMCs zwischen HAPH-Patienten ( n = 7) und Kontrollteilnehmern ( n = 5) vergleichen. Dargestellt sind die zweiseitigen p- Werte aus dem Wilcoxon-Rangsummentest. d Anteile jedes Zelltyps bei HAPH-Patienten ( n = 7) und Kontrollteilnehmern ( n = 5). HAPH pulmonale Hypertonie in großer Höhe, t-SNE t-verteilte stochastische Nachbareinbettung, PBMCs mononukleäre Zellen des peripheren Blutes.
Definition von Monozyten-Untergruppen und deren Assoziationen mit HAPHMenschliche Monozyten bestehen aus phänotypisch und funktionell unterschiedlichen Subpopulationen
18
. Frühere Studien haben auf einen entscheidenden Beitrag von Monozyten zur Pathophysiologie von PH hingewiesen
14
,
19
,
20
. Aufgrund der hohen Häufigkeit von Monozyten und ihrer Assoziation mit HAPH haben wir unsere Analyse daher auf Monozyten konzentriert. Bei allen Monozyten wurde eine unbeaufsichtigte Clusterbildung durchgeführt, wobei drei Hauptsubcluster identifiziert wurden: die Monozyten C0, C1 und C2 (Abb.
3a – c
). Die unterschiedlich exprimierten Genlisten sind in der Ergänzungstabelle
2
für C0, C1 bzw. C2 aufgeführt. Monozyten-C0-Zellen exprimierten die klassischen Monozytenmarker CD14, Phospholipase-B-Domäne enthaltend 1 (PLBD1), die proinflammatorischen Mediatoren S100-Calcium-Bindungsprotein A2 (S100A12) und S100A8, während das Fc-Fragment des IgG-Rezeptors IIIa (FCGR3A)/CD16 vorhanden war selten exprimiert (Abb.
3d
), was der Hauptpopulation von Monozyten, den klassischen (CD14 + CD16 - ) Monozyten
18
,
21
,
22,
ähnelte . Monozyten-C1-Zellen exprimierten die höchste Konzentration an FCGR3A/CD16 und mittlere Konzentrationen an CD14, mit einer Hochregulierung des Ras-Homolog-Genfamilienmitglieds C (RHOC), der Hämoxygenase 1 (HMOX1), der Kinasen der Src-Familie, die die hämopoetische Zellkinase (HCK) bilden, und Tyrosin Proteinkinase Lyn (LYN) und Komplementkomponente 1 q Unterkomponente-α-Polypeptid (C1QA) (Abb.
3d
). Die RNA-Expressionsprofile von Monozyten-C1-Zellen ähnelten denen von nicht-klassischen (z. B. CD14 - CD16 + ) Monozyten, wie zuvor berichtet
22
,
23
. Während Monozyten-C2-Zellen relativ geringere Expressionen von FCGR3A/CD16 zeigten (Abb.
3d ), die denen von intermediären (z. B. CD14
- CD16 - ) Monozyten ähnelten
21
,
23
.Abb. 3: Ausbreitung von Monozytenclustern im Kreislaufsystem von Patienten mit HAPH.
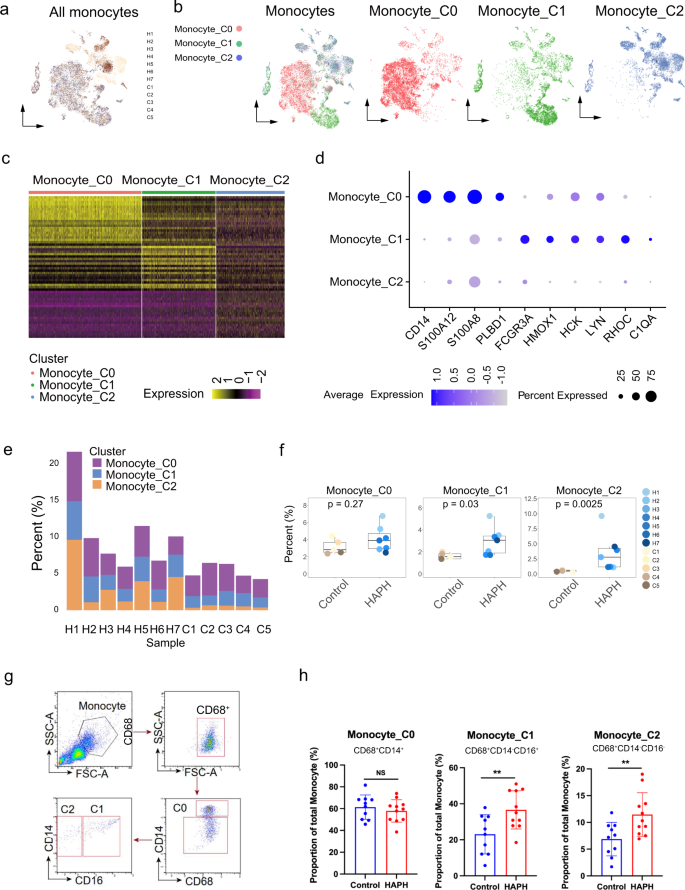 ein t-SNE-Diagramm aller in der vorliegenden Studie gesammelten Monozyten. b t-SNE-Diagramm aller Monozyten und der Subcluster mit gefärbten Zellen basierend auf kanonischen Genmarkern von Monozyten. Cluster 0 (C0) werden als klassische Monozyten dargestellt, C1 als nichtklassische Monozyten und C2 als intermediäre Monozyten. c Heatmap, die die skalierten Expressionswerte diskriminierender Gensätze aller Monozyten in PBMCs zwischen HAPH und Kontrollen anzeigt. Die Top 50 Markergene in jeder Untergruppe wurden angezeigt. d Violindiagramme, die die Expression von Genen in jedem Monozytencluster in PBMCs sowohl von HAPH als auch von Kontrollen anzeigen. e Anteile jedes Monozytenclusters in jeder Probe wie angegeben. f Boxplots, die die Prozentsätze jedes Monozytenclusters in PBMCs zwischen HAPH-Patienten ( n = 7) und Kontrollteilnehmern ( n = 5) vergleichen. Dargestellt sind die zweiseitigen p- Werte aus dem Wilcoxon-Rangsummentest. g Gating-Strategie von Monozyten mittels Durchflusszytometrie. h Der Vergleich des Anteils jeder Monozyten-Untergruppe in PBMCs zwischen HAPH-Patienten ( n = 11) und Kontrollen ( n = 10), ermittelt durch Durchflusszytometrie. (* p < 0,05; Der ungepaarte t- Test wurde entsprechend verwendet. Die Daten wurden als Mittelwert ± SD dargestellt. ) HAPH pulmonale Hypertonie in großer Höhe, t-SNE t-verteilte stochastische Nachbareinbettung, PBMCs mononukleäre Zellen des peripheren Blutes.
Als nächstes analysierten wir die Häufigkeiten der drei Monozyten-Subpopulationen zwischen der Fall- und der Kontrollgruppe. Interessanterweise stellten wir fest, dass sowohl C1- als auch C2-Monozyten bei den Patienten häufiger vorkamen (Abb.
3e, f,
p < 0,05 für alle Vergleiche, zweiseitiger Wilcoxon-Rangsummentest). Insbesondere machten die Monozyten C1 (nicht klassisch) und C2 (intermediär) 1,35 % bis 2,01 % bzw. 0,35 % bis 0,67 % der gesamten in PBMCs der Kontrollpersonen analysierten Zellen aus, während die Häufigkeit auf 1,71 % anstieg. ~5,26 % bzw. 1,09 % ~9,62 % bei HAPH-Patienten (Abb.
3e, f
). Bei HAPH-Patienten wurden im Vergleich zu den Kontrollpersonen signifikant höhere Häufigkeiten von C1 und C2 festgestellt (Abb.
3
g – i). Der Korrelationskoeffizient der klinischen Parameter und Anteile der Monozyten-Subtypen ist in der Ergänzungstabelle
3
aufgeführt . Somit deuten unsere Daten darauf hin, dass C1-Monozyten (nicht klassisch) und C2-Monozyten (intermediär) möglicherweise maßgeblich an der Pathophysiologie von HAPH beteiligt sind.Funktionelle Charakterisierung verschiedener mit HAPH assoziierter Monozyten-UntergruppenUm die globalen Funktionen verschiedener Monozyten-Untergruppen bei der HAPH-Entwicklung besser zu verstehen, haben wir die DEGs und Pfade in jeder Monozyten-Untergruppe zwischen Fällen und Kontrollen untersucht. Wie erwartet wurde in jeder Monozyten-Untergruppe eine große Anzahl von DEGs identifiziert (siehe Ergänzende Daten
1–3
), und die Top
100
DEGs wurden auf verschiedenen Wegen angereichert, einschließlich Reaktionen auf Viren, Regulierung der Lymphozytenaktivierung, Leukozyten-Zell-Zell-Adhäsion, Interleukin-2 (IL-2)-Produktion, IL-4- und IL-13-Signalisierung und immunregulatorische Wechselwirkungen zwischen lymphoiden und nichtlymphoiden Zellen (Abb.
4a – c
und ergänzende Abb.
4
–
6
). Die angereicherten biologischen Prozesse der herunterregulierten Top100-Gene zwischen Monozyten-Subclustern zwischen Fällen und Kontrollen wurden in der ergänzenden Abbildung
7
dargestellt , und die Signalweganalyse von DEGs in anderen Immunzellen wurde ebenfalls durchgeführt (ergänzende Abbildung
8
). Darüber hinaus stellten wir fest, dass die Zellkommunikation zwischen der Monozyten-C1-Untergruppe und anderen Zelltypen in PBMCs von HAPH-Patienten im Vergleich zu den Kontrollen tendenziell relativ schwach war (ergänzende Abbildung
9
). Ein ähnlicher Befund wurde in der Monozyten-C2-Subpopulation beobachtet (ergänzende Abbildung
10
).Abb. 4: Unterschiedliche biologische Wege in jedem Monozytencluster zwischen HAPH-Patienten und Kontrollpersonen.
ein t-SNE-Diagramm aller in der vorliegenden Studie gesammelten Monozyten. b t-SNE-Diagramm aller Monozyten und der Subcluster mit gefärbten Zellen basierend auf kanonischen Genmarkern von Monozyten. Cluster 0 (C0) werden als klassische Monozyten dargestellt, C1 als nichtklassische Monozyten und C2 als intermediäre Monozyten. c Heatmap, die die skalierten Expressionswerte diskriminierender Gensätze aller Monozyten in PBMCs zwischen HAPH und Kontrollen anzeigt. Die Top 50 Markergene in jeder Untergruppe wurden angezeigt. d Violindiagramme, die die Expression von Genen in jedem Monozytencluster in PBMCs sowohl von HAPH als auch von Kontrollen anzeigen. e Anteile jedes Monozytenclusters in jeder Probe wie angegeben. f Boxplots, die die Prozentsätze jedes Monozytenclusters in PBMCs zwischen HAPH-Patienten ( n = 7) und Kontrollteilnehmern ( n = 5) vergleichen. Dargestellt sind die zweiseitigen p- Werte aus dem Wilcoxon-Rangsummentest. g Gating-Strategie von Monozyten mittels Durchflusszytometrie. h Der Vergleich des Anteils jeder Monozyten-Untergruppe in PBMCs zwischen HAPH-Patienten ( n = 11) und Kontrollen ( n = 10), ermittelt durch Durchflusszytometrie. (* p < 0,05; Der ungepaarte t- Test wurde entsprechend verwendet. Die Daten wurden als Mittelwert ± SD dargestellt. ) HAPH pulmonale Hypertonie in großer Höhe, t-SNE t-verteilte stochastische Nachbareinbettung, PBMCs mononukleäre Zellen des peripheren Blutes.
Als nächstes analysierten wir die Häufigkeiten der drei Monozyten-Subpopulationen zwischen der Fall- und der Kontrollgruppe. Interessanterweise stellten wir fest, dass sowohl C1- als auch C2-Monozyten bei den Patienten häufiger vorkamen (Abb.
3e, f,
p < 0,05 für alle Vergleiche, zweiseitiger Wilcoxon-Rangsummentest). Insbesondere machten die Monozyten C1 (nicht klassisch) und C2 (intermediär) 1,35 % bis 2,01 % bzw. 0,35 % bis 0,67 % der gesamten in PBMCs der Kontrollpersonen analysierten Zellen aus, während die Häufigkeit auf 1,71 % anstieg. ~5,26 % bzw. 1,09 % ~9,62 % bei HAPH-Patienten (Abb.
3e, f
). Bei HAPH-Patienten wurden im Vergleich zu den Kontrollpersonen signifikant höhere Häufigkeiten von C1 und C2 festgestellt (Abb.
3
g – i). Der Korrelationskoeffizient der klinischen Parameter und Anteile der Monozyten-Subtypen ist in der Ergänzungstabelle
3
aufgeführt . Somit deuten unsere Daten darauf hin, dass C1-Monozyten (nicht klassisch) und C2-Monozyten (intermediär) möglicherweise maßgeblich an der Pathophysiologie von HAPH beteiligt sind.Funktionelle Charakterisierung verschiedener mit HAPH assoziierter Monozyten-UntergruppenUm die globalen Funktionen verschiedener Monozyten-Untergruppen bei der HAPH-Entwicklung besser zu verstehen, haben wir die DEGs und Pfade in jeder Monozyten-Untergruppe zwischen Fällen und Kontrollen untersucht. Wie erwartet wurde in jeder Monozyten-Untergruppe eine große Anzahl von DEGs identifiziert (siehe Ergänzende Daten
1–3
), und die Top
100
DEGs wurden auf verschiedenen Wegen angereichert, einschließlich Reaktionen auf Viren, Regulierung der Lymphozytenaktivierung, Leukozyten-Zell-Zell-Adhäsion, Interleukin-2 (IL-2)-Produktion, IL-4- und IL-13-Signalisierung und immunregulatorische Wechselwirkungen zwischen lymphoiden und nichtlymphoiden Zellen (Abb.
4a – c
und ergänzende Abb.
4
–
6
). Die angereicherten biologischen Prozesse der herunterregulierten Top100-Gene zwischen Monozyten-Subclustern zwischen Fällen und Kontrollen wurden in der ergänzenden Abbildung
7
dargestellt , und die Signalweganalyse von DEGs in anderen Immunzellen wurde ebenfalls durchgeführt (ergänzende Abbildung
8
). Darüber hinaus stellten wir fest, dass die Zellkommunikation zwischen der Monozyten-C1-Untergruppe und anderen Zelltypen in PBMCs von HAPH-Patienten im Vergleich zu den Kontrollen tendenziell relativ schwach war (ergänzende Abbildung
9
). Ein ähnlicher Befund wurde in der Monozyten-C2-Subpopulation beobachtet (ergänzende Abbildung
10
).Abb. 4: Unterschiedliche biologische Wege in jedem Monozytencluster zwischen HAPH-Patienten und Kontrollpersonen.
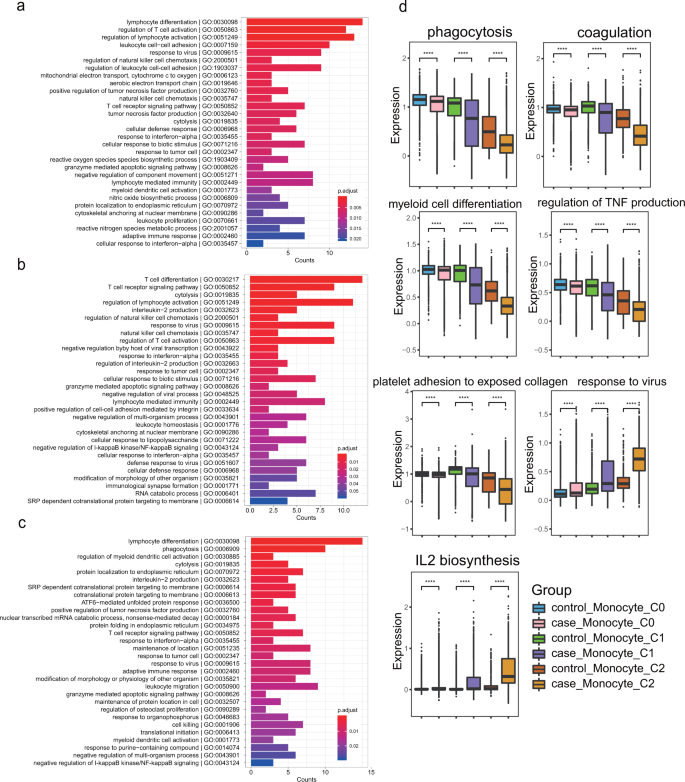 Genontologieanalyse (biologischer Prozess) der DEGs in C0 ( a ), C1 ( b ) und C2 ( c ) Monozyten zwischen den HAPH- und Kontrollproben. d Boxplot, der den mittleren Pathway-Signatur-Score jeder Monozyten-Untergruppe aus jeder Gruppe zeigt. *** p < 0,001; **** p < 0,0001; unter Verwendung des ungepaarten Wilcox-Rangsummentests. HAPH pulmonale Hypertonie in großer Höhe, DEGs exprimierten Gene unterschiedlich.
Es ist bekannt, dass Monozyten funktionell für Phagozytose, Koagulation, Wundheilung, antiapoptotische Reaktionen und Reaktionen auf Reize verantwortlich sind
18
. Daher haben wir analysiert, wie diese biologischen Prozesse in den verschiedenen Proben moduliert wurden. Interessanterweise stellten wir fest, dass HAPH-Patienten niedrigere Signaturwerte aufwiesen, die für die Signalwege (z. B. Phagozytose, Differenzierung myeloider Zellen, Koagulation, Adhäsion von Blutplättchen an freiliegendem Kollagen und Regulierung der TNF-Produktion usw.) relevant sind, im Vergleich zu Kontrollpersonen, die unabhängig von Monozyten-Untergruppen waren. während dies deutlicher bei C1- (nichtklassischen) und C2-Monozyten (mittlere Phase) der Fall ist (Abb.
4d
). Diese Beobachtungen lassen darauf schließen, dass HAPH-Patienten unter einer schweren Beeinträchtigung der Monozytenfunktionen leiden könnten. Darüber hinaus stellten wir fest, dass die mit der Reaktion auf das Virus und die IL-2-Biosynthese verbundenen Gene in den aus den HAPH-Proben erhaltenen C1- und C2-Clustern deutlich hochreguliert waren (Abb.
4d
), was darauf hindeutet, dass bei diesen Patienten möglicherweise spezifische immunologische Reaktionen ausgelöst werden .Als nächstes haben wir die Beiträge der Gene, die an jedem biologischen Signalweg beteiligt sind, in Abb.
4d
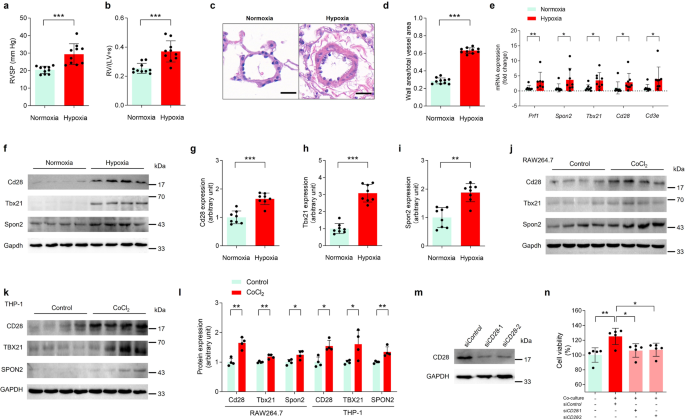
geordnet und drei Gene mit der größten Faltungsänderung in jedem biologischen Signalweg ausgewählt. Aus den 7 Signalwegen wurden insgesamt 15 Kandidatengene bestimmt. Zunächst haben wir ein Hypoxie-induziertes PH-Modell bei Mäusen etabliert, wobei ein höherer RVSP durch Rechtsherzkatheterisierung (Abb.
5a
), rechtsventrikulären Hypertrophieindex (Abb.
5b
) und histopathologische Bewertung (Abb.
5c, d
) identifiziert wurde. Wir analysierten die mRNA-Expressionsniveaus von 15 Genen im Lungengewebe hypoxischer PH-Mäuse und stellten fest, dass die Expression von 5 Genen ( Prf1 , Spon2 , Tbx21 , Cd28 und Cd3e ) im Vergleich zu der in Kontrollmäusen signifikant erhöht war (Abb.
5e
). , die mit den Ergebnissen der scRNA-seq-Analyse bei HAPH-Patienten übereinstimmten. Die restlichen 10 Gene zeigten keinen signifikanten Unterschied im Lungengewebe hypoxischer PH-Mäuse (ergänzende Abbildung
11
). Als nächstes analysierten wir 5 Gene quantitativ auf Proteinebene und stellten fest, dass Cd28 , Tbx21 und Spon2 im Lungengewebe von hypoxischen PH-Mäusen signifikant erhöht waren (Abb.
5f
–
i
, ergänzende Abb.
12
), entsprechend ihrer Transkription Ebenen. Die Expressionsniveaus von Prf1 und Cd3e wurden im Lungengewebe hypoxischer PH-Mäuse nicht effektiv nachgewiesen (ergänzende Abbildung
12
). Ein zelluläres Modell chemisch induzierter Hypoxie zeigte, dass Cd28, Tbx21 und Spon2 sowohl in RAW264.7-Monozyten/Makrophagen als auch in THP-1-Monozyten, die als Reaktion auf CoCl 2 induziert wurden, signifikant erhöht waren (Abb.
5
j–
l
, ergänzende Abb.
13
). . Die Co-Kultivierung mit Jurkat-Klon-E6-1-Zellen führte zu einer Erhöhung der Zelllebensfähigkeit menschlicher PASMCs, und der Abbau von CD28 in Jurkat-Klon-E6-1-Zellen hemmte diesen Effekt deutlich (Abb.
5
j,
k
). Weder der TBX21- noch der SPON2- Knockdown zeigten ähnliche signifikante Hemmwirkungen (Ergänzende Abbildungen
14
,
15
).Abb. 5: Genfunktionsvalidierung bei hypoxischen PH-Mäusen.
Genontologieanalyse (biologischer Prozess) der DEGs in C0 ( a ), C1 ( b ) und C2 ( c ) Monozyten zwischen den HAPH- und Kontrollproben. d Boxplot, der den mittleren Pathway-Signatur-Score jeder Monozyten-Untergruppe aus jeder Gruppe zeigt. *** p < 0,001; **** p < 0,0001; unter Verwendung des ungepaarten Wilcox-Rangsummentests. HAPH pulmonale Hypertonie in großer Höhe, DEGs exprimierten Gene unterschiedlich.
Es ist bekannt, dass Monozyten funktionell für Phagozytose, Koagulation, Wundheilung, antiapoptotische Reaktionen und Reaktionen auf Reize verantwortlich sind
18
. Daher haben wir analysiert, wie diese biologischen Prozesse in den verschiedenen Proben moduliert wurden. Interessanterweise stellten wir fest, dass HAPH-Patienten niedrigere Signaturwerte aufwiesen, die für die Signalwege (z. B. Phagozytose, Differenzierung myeloider Zellen, Koagulation, Adhäsion von Blutplättchen an freiliegendem Kollagen und Regulierung der TNF-Produktion usw.) relevant sind, im Vergleich zu Kontrollpersonen, die unabhängig von Monozyten-Untergruppen waren. während dies deutlicher bei C1- (nichtklassischen) und C2-Monozyten (mittlere Phase) der Fall ist (Abb.
4d
). Diese Beobachtungen lassen darauf schließen, dass HAPH-Patienten unter einer schweren Beeinträchtigung der Monozytenfunktionen leiden könnten. Darüber hinaus stellten wir fest, dass die mit der Reaktion auf das Virus und die IL-2-Biosynthese verbundenen Gene in den aus den HAPH-Proben erhaltenen C1- und C2-Clustern deutlich hochreguliert waren (Abb.
4d
), was darauf hindeutet, dass bei diesen Patienten möglicherweise spezifische immunologische Reaktionen ausgelöst werden .Als nächstes haben wir die Beiträge der Gene, die an jedem biologischen Signalweg beteiligt sind, in Abb.
4d
geordnet und drei Gene mit der größten Faltungsänderung in jedem biologischen Signalweg ausgewählt. Aus den 7 Signalwegen wurden insgesamt 15 Kandidatengene bestimmt. Zunächst haben wir ein Hypoxie-induziertes PH-Modell bei Mäusen etabliert, wobei ein höherer RVSP durch Rechtsherzkatheterisierung (Abb.
5a
), rechtsventrikulären Hypertrophieindex (Abb.
5b
) und histopathologische Bewertung (Abb.
5c, d
) identifiziert wurde. Wir analysierten die mRNA-Expressionsniveaus von 15 Genen im Lungengewebe hypoxischer PH-Mäuse und stellten fest, dass die Expression von 5 Genen ( Prf1 , Spon2 , Tbx21 , Cd28 und Cd3e ) im Vergleich zu der in Kontrollmäusen signifikant erhöht war (Abb.
5e
). , die mit den Ergebnissen der scRNA-seq-Analyse bei HAPH-Patienten übereinstimmten. Die restlichen 10 Gene zeigten keinen signifikanten Unterschied im Lungengewebe hypoxischer PH-Mäuse (ergänzende Abbildung
11
). Als nächstes analysierten wir 5 Gene quantitativ auf Proteinebene und stellten fest, dass Cd28 , Tbx21 und Spon2 im Lungengewebe von hypoxischen PH-Mäusen signifikant erhöht waren (Abb.
5f
–
i
, ergänzende Abb.
12
), entsprechend ihrer Transkription Ebenen. Die Expressionsniveaus von Prf1 und Cd3e wurden im Lungengewebe hypoxischer PH-Mäuse nicht effektiv nachgewiesen (ergänzende Abbildung
12
). Ein zelluläres Modell chemisch induzierter Hypoxie zeigte, dass Cd28, Tbx21 und Spon2 sowohl in RAW264.7-Monozyten/Makrophagen als auch in THP-1-Monozyten, die als Reaktion auf CoCl 2 induziert wurden, signifikant erhöht waren (Abb.
5
j–
l
, ergänzende Abb.
13
). . Die Co-Kultivierung mit Jurkat-Klon-E6-1-Zellen führte zu einer Erhöhung der Zelllebensfähigkeit menschlicher PASMCs, und der Abbau von CD28 in Jurkat-Klon-E6-1-Zellen hemmte diesen Effekt deutlich (Abb.
5
j,
k
). Weder der TBX21- noch der SPON2- Knockdown zeigten ähnliche signifikante Hemmwirkungen (Ergänzende Abbildungen
14
,
15
).Abb. 5: Genfunktionsvalidierung bei hypoxischen PH-Mäusen.
 C57BL/6-Mäuse , die 4 Wochen lang Hypoxie (10 % O 2 ) ausgesetzt waren, zeigten höhere RVSP ( a ) und RVHI ( b ) im Vergleich zu Mäusen in Normoxie (21 % O 2 ) ( n = 10 für jede Gruppe, ** * p < 0,001; Student- t -Test. Da t a wurden als Mittelwert ± SD dargestellt. c Repräsentative Bilder der Hämatoxylin- und Eosin-Färbung (H&E) von Lungengewebe von Mäusen unter normoxischen oder hypoxischen Bedingungen. Maßstabsbalken, 20 μm. d Bewertung der pulmonalen Gefäßumgestaltung durch Bestimmung des Verhältnisses der Media-Querschnittsfläche zur Gesamtgefäß-Querschnittsfläche in jeder Gruppe ( n = 10 für jede Gruppe, *** p < 0,001; Student- t- Test. Die Daten waren dargestellt als Mittelwert ± SD). e Die Expression von Prf1 , Spon2 , Tbx21 , Cd28 und Cd3e im Lungengewebe der Mäuse unter normoxischen oder hypoxischen Bedingungen auf mRNA-Ebene ( n = 7–8 für jede Gruppe, * p < 0,05, ** p < 0,01; Student's t Test. Die Daten wurden als Mittelwert ± SD dargestellt. f – i Repräsentative Bilder von Immunblottings und der Quantifizierung der Expression von Cd28 ( g ), Spon2 ( h ) und Tbx21 ( i ) in Lungengeweben der Kontrollmäuse und hypoxischen PH-Mäuse auf Proteinniveau ( n = 8 für pro Gruppe, ** p < 0,01, *** p < 0,001; Student- t- Test. Die Daten wurden als Mittelwert ± SD dargestellt. j Immunblottings für die Expression von Cd28, Tbx21 und Spon2 in RAW264.7-Monozyten/Makrophagen als Reaktion auf CoCl 2 (150 μmol/L) oder Vehikel für 24 Stunden. k Immunblottings für die Expression von CD28, TBX21 und SPON2 in THP-1-Monozyten als Reaktion auf CoCl 2 (150 μmol/L) oder Vehikel für 24 Stunden. l Quantifizierung der Expression von Cd28 (CD28), Tbx21 (TBX21) und Spon2 (SPON2) in RAW264.7- und THP-1-Zellen ( n = 4 für jede Gruppe, * p < 0,05, ** p < 0,01; Student's t Test. Die Daten wurden als Mittelwert ± SD dargestellt. m Repräsentative Bilder von Immunblottings von Jurkat-Klon-E6-1-Zellen, die mit CD28-siRNA (si CD28 ) oder Kontroll-siRNA (si Control ) transfiziert wurden. NLebensfähigkeit menschlicher PASMCs, die mit oder ohne CD28- Stummschaltung oder Kontroll-Jurkat-Zellen für 48 Stunden kokultiviert wurden ( n = 5 für jede Gruppe, * p < 0,05, ** p < 0,01; einfache ANOVA, Tukeys Post-hoc-Test. Die Daten wurden als Mittelwert ± SD dargestellt. PH pulmonale Hypertonie, RVSP rechtsventrikulärer systolischer Druck, RVHI rechtsventrikulärer Hypertrophieindex, PASMCs pulmonale arterielle glatte Muskelzellen. Prf1 Perforin 1, Spon2, Spondin 2, Tbx21 T-Box-Transkriptionsfaktor 21.
Verminderter Hypoxie-induzierbarer Transkriptionsfaktor-1α (HIF-1α) in allen mit HAPH assoziierten Monozyten-UntergruppenEs ist offensichtlich, dass HIF-1α und HIF-2α an der Pathophysiologie des Lungengefäßumbaus beteiligt sind
11
,
12
,
13
. Daher haben wir in unserer Untersuchung umfassend untersucht, ob HIFs mit HAPH assoziiert sind. Der Analyse zufolge unterschied sich HIF-1α nicht zwischen HAPH-Patienten und Kontrollpersonen in allen PBMCs, NK-Zellen, B-Zellen oder T-Zellen (Abb.
6a, d
), während HIF-2α nicht in allen Proben effizient nachgewiesen wurde. Bemerkenswerterweise wurde in den Monozyten zwischen HAPH-Patienten und Kontrollpersonen eine deutliche Herunterregulierung der HIF-1α-Expression festgestellt (Abb.
6e
). Insbesondere zeigten die C0-Monozyten (klassisch) und C1-Monozyten (nichtklassisch) in HAPH im Vergleich zu den Kontrollen eine geringere Expression von HIF-1α (Abb.
6
f). Unterdessen war die Expression von VEGFA (einem wichtigen Downstream-Protein von HIF-1α) bei HAPH-Patienten unabhängig von Monozyten-Untergruppen im Vergleich zu Kontrollteilnehmern viel geringer, ein ähnlicher Trend wie der von HIF-1α zwischen den beiden Gruppen (Abb.
6g– ich
). Die Korrelation der klinischen Parameter und der Expression von HIF1-α und seinem Zielgen VEGFA ist in der Ergänzungstabelle
4
dargestellt . Wir untersuchten auch die Hif-1α-Expression im Lungengewebe von PH-Mäusen und ihre Expression als Reaktion auf ein Hypoxie-mimetisches Mittel. Wie in den ergänzenden Abbildungen
16
und
17
gezeigt , war Hif-1α bei Lungenproblemen von durch Hypoxie verursachten Mäusen signifikant höher als bei den Kontrollen (ergänzende Abbildungen
16a, b
und ergänzende Abbildungen
17a, b
). Auf zellulärer Ebene war Hif-1α (HIF-1α) ebenfalls signifikant erhöht, sowohl in RAW264.7-Monozyten/Makrophagen (Ergänzung Abb.
16c
, d und
17c, d ) als auch in THP-1-Monozyten, die als Reaktion auf CoCl
2 induziert wurden (Ergänzung). Abb.
16e
, f und
17e, f
). Zusammenfassend deuten unsere Daten darauf hin, dass HAPH-Patienten möglicherweise an einer Beeinträchtigung der HIF-1α-vermittelten Signalübertragung in den Monozyten des zirkulierenden Systems leiden.Abb. 6: Vergleich der Expression von HIF-1α und VEGF1 in der Immunzellpopulation zwischen HAPH und Kontrollen.
C57BL/6-Mäuse , die 4 Wochen lang Hypoxie (10 % O 2 ) ausgesetzt waren, zeigten höhere RVSP ( a ) und RVHI ( b ) im Vergleich zu Mäusen in Normoxie (21 % O 2 ) ( n = 10 für jede Gruppe, ** * p < 0,001; Student- t -Test. Da t a wurden als Mittelwert ± SD dargestellt. c Repräsentative Bilder der Hämatoxylin- und Eosin-Färbung (H&E) von Lungengewebe von Mäusen unter normoxischen oder hypoxischen Bedingungen. Maßstabsbalken, 20 μm. d Bewertung der pulmonalen Gefäßumgestaltung durch Bestimmung des Verhältnisses der Media-Querschnittsfläche zur Gesamtgefäß-Querschnittsfläche in jeder Gruppe ( n = 10 für jede Gruppe, *** p < 0,001; Student- t- Test. Die Daten waren dargestellt als Mittelwert ± SD). e Die Expression von Prf1 , Spon2 , Tbx21 , Cd28 und Cd3e im Lungengewebe der Mäuse unter normoxischen oder hypoxischen Bedingungen auf mRNA-Ebene ( n = 7–8 für jede Gruppe, * p < 0,05, ** p < 0,01; Student's t Test. Die Daten wurden als Mittelwert ± SD dargestellt. f – i Repräsentative Bilder von Immunblottings und der Quantifizierung der Expression von Cd28 ( g ), Spon2 ( h ) und Tbx21 ( i ) in Lungengeweben der Kontrollmäuse und hypoxischen PH-Mäuse auf Proteinniveau ( n = 8 für pro Gruppe, ** p < 0,01, *** p < 0,001; Student- t- Test. Die Daten wurden als Mittelwert ± SD dargestellt. j Immunblottings für die Expression von Cd28, Tbx21 und Spon2 in RAW264.7-Monozyten/Makrophagen als Reaktion auf CoCl 2 (150 μmol/L) oder Vehikel für 24 Stunden. k Immunblottings für die Expression von CD28, TBX21 und SPON2 in THP-1-Monozyten als Reaktion auf CoCl 2 (150 μmol/L) oder Vehikel für 24 Stunden. l Quantifizierung der Expression von Cd28 (CD28), Tbx21 (TBX21) und Spon2 (SPON2) in RAW264.7- und THP-1-Zellen ( n = 4 für jede Gruppe, * p < 0,05, ** p < 0,01; Student's t Test. Die Daten wurden als Mittelwert ± SD dargestellt. m Repräsentative Bilder von Immunblottings von Jurkat-Klon-E6-1-Zellen, die mit CD28-siRNA (si CD28 ) oder Kontroll-siRNA (si Control ) transfiziert wurden. NLebensfähigkeit menschlicher PASMCs, die mit oder ohne CD28- Stummschaltung oder Kontroll-Jurkat-Zellen für 48 Stunden kokultiviert wurden ( n = 5 für jede Gruppe, * p < 0,05, ** p < 0,01; einfache ANOVA, Tukeys Post-hoc-Test. Die Daten wurden als Mittelwert ± SD dargestellt. PH pulmonale Hypertonie, RVSP rechtsventrikulärer systolischer Druck, RVHI rechtsventrikulärer Hypertrophieindex, PASMCs pulmonale arterielle glatte Muskelzellen. Prf1 Perforin 1, Spon2, Spondin 2, Tbx21 T-Box-Transkriptionsfaktor 21.
Verminderter Hypoxie-induzierbarer Transkriptionsfaktor-1α (HIF-1α) in allen mit HAPH assoziierten Monozyten-UntergruppenEs ist offensichtlich, dass HIF-1α und HIF-2α an der Pathophysiologie des Lungengefäßumbaus beteiligt sind
11
,
12
,
13
. Daher haben wir in unserer Untersuchung umfassend untersucht, ob HIFs mit HAPH assoziiert sind. Der Analyse zufolge unterschied sich HIF-1α nicht zwischen HAPH-Patienten und Kontrollpersonen in allen PBMCs, NK-Zellen, B-Zellen oder T-Zellen (Abb.
6a, d
), während HIF-2α nicht in allen Proben effizient nachgewiesen wurde. Bemerkenswerterweise wurde in den Monozyten zwischen HAPH-Patienten und Kontrollpersonen eine deutliche Herunterregulierung der HIF-1α-Expression festgestellt (Abb.
6e
). Insbesondere zeigten die C0-Monozyten (klassisch) und C1-Monozyten (nichtklassisch) in HAPH im Vergleich zu den Kontrollen eine geringere Expression von HIF-1α (Abb.
6
f). Unterdessen war die Expression von VEGFA (einem wichtigen Downstream-Protein von HIF-1α) bei HAPH-Patienten unabhängig von Monozyten-Untergruppen im Vergleich zu Kontrollteilnehmern viel geringer, ein ähnlicher Trend wie der von HIF-1α zwischen den beiden Gruppen (Abb.
6g– ich
). Die Korrelation der klinischen Parameter und der Expression von HIF1-α und seinem Zielgen VEGFA ist in der Ergänzungstabelle
4
dargestellt . Wir untersuchten auch die Hif-1α-Expression im Lungengewebe von PH-Mäusen und ihre Expression als Reaktion auf ein Hypoxie-mimetisches Mittel. Wie in den ergänzenden Abbildungen
16
und
17
gezeigt , war Hif-1α bei Lungenproblemen von durch Hypoxie verursachten Mäusen signifikant höher als bei den Kontrollen (ergänzende Abbildungen
16a, b
und ergänzende Abbildungen
17a, b
). Auf zellulärer Ebene war Hif-1α (HIF-1α) ebenfalls signifikant erhöht, sowohl in RAW264.7-Monozyten/Makrophagen (Ergänzung Abb.
16c
, d und
17c, d ) als auch in THP-1-Monozyten, die als Reaktion auf CoCl
2 induziert wurden (Ergänzung). Abb.
16e
, f und
17e, f
). Zusammenfassend deuten unsere Daten darauf hin, dass HAPH-Patienten möglicherweise an einer Beeinträchtigung der HIF-1α-vermittelten Signalübertragung in den Monozyten des zirkulierenden Systems leiden.Abb. 6: Vergleich der Expression von HIF-1α und VEGF1 in der Immunzellpopulation zwischen HAPH und Kontrollen.
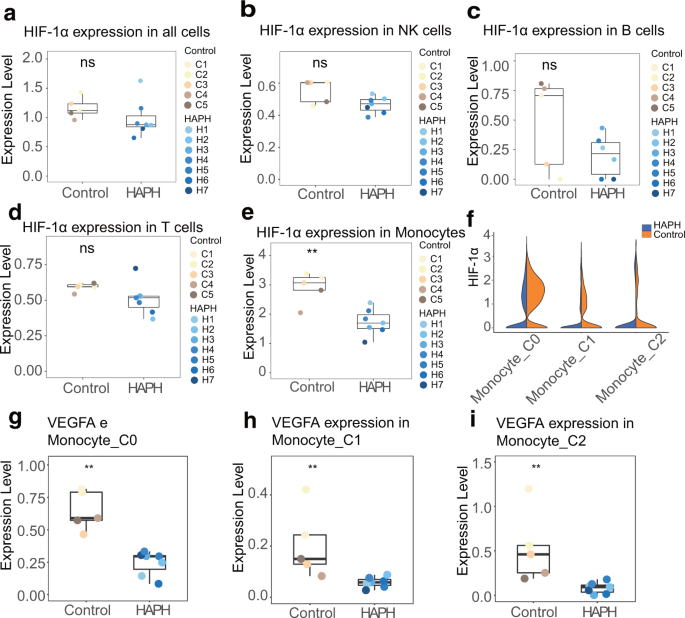 Boxplots, die die Expression von HIF-1α bei HAPH-Patienten im Vergleich zu der in Kontrollen in der angegebenen Zellpopulation zeigen ( a : alle Zellen, b : NK-Zellen, c : B-Zellen, d : T-Zellen und e : Monozyten). ** p < 0,01; ns nicht signifikant im ungepaarten zweiseitigen t- Test. f Boxdiagramme, die den Vergleich der Expression von HIF-1α in jedem Monozytencluster zwischen HAPH-Patienten ( n = 7) und Kontrollen ( n = 5) zeigen. g – i Boxdiagramme, die den Vergleich der Expression von VEGFA in jedem Monozytencluster zwischen HAPH-Patienten ( n = 7) und Kontrollen ( n = 5) zeigen. HIF-1α Hypoxie-induzierbarer Faktor-1α, VEGF vaskulärer endothelialer Wachstumsfaktor, HAPH pulmonale Hypertonie in großer Höhe, NK-Zellen natürliche Killerzellen.
Vergleich der Immunzellzusammensetzungen in PBMCs zwischen HAPH- und PH-PatientenUm die Immunanpassungen mit HAPH und PH zu vergleichen, wurden 6 PH-Patienten rekrutiert (Ergänzungstabelle
5
). Anschließend führten wir eine scRNA-Seq an PBMCs von PH-Patienten durch. Die PH-Immunlandschaft wurde nach dem gleichen Analyse-Workflow dargestellt. Wir identifizierten 11 Zelltypen gemäß den kanonischen Markern, darunter Monozyten, NK-Zellen, CD4 + , CD8 + und regulatorische T-Zellen, Gedächtnis- und naive B-Zellen, cDC, pDC und HSCs (Abb.
7a, b
). Davon machten Monozyten 26,7 % aus. Der Landschaftsvergleich von HAPH und PH zeigte, dass ihre Immunanpassungen sowohl hinsichtlich der Zelltypzusammensetzung als auch der Zellfraktionen in jeder Population ähnlich waren (Abb.
7c, d
). Ähnliche Zellanteile von CD4 + T-Zellen, CD8 + T-Zellen und NK-Zellen wurden in PH wie in HAPH dokumentiert (Abb.
7e, f
). Bemerkenswert ist, dass beim Vergleich der Monozyten-Untergruppen zwischen HAPH und PH C2 einen signifikant höheren Anteil bei HAPH aufwies, was bei C0 und C1 nicht der Fall war (Abb.
7
g). Ein einzelner tSNE aller Proben wurde generiert, um Cluster mit denselben Analyseparametern zu identifizieren (ergänzende Abbildung
18
). tSNE-Diagramme einzelner Proben wurden in ergänzender Abbildung
19
gezeigt . Die Häufigkeiten der drei Monozyten-Untergruppen wurden bei HAPH-Patienten, PH-Patienten und Kontrollpersonen verglichen (ergänzende Abbildung
20
). Insgesamt deutete die scRNA-seq von PBMC darauf hin, dass bei HAPH und PH ähnliche Immunanpassungen existieren könnten.Abb. 7: Immunzellzusammensetzung im Kreislaufsystem von Patienten mit PH und ihr Vergleich mit denen bei HAPH.
Boxplots, die die Expression von HIF-1α bei HAPH-Patienten im Vergleich zu der in Kontrollen in der angegebenen Zellpopulation zeigen ( a : alle Zellen, b : NK-Zellen, c : B-Zellen, d : T-Zellen und e : Monozyten). ** p < 0,01; ns nicht signifikant im ungepaarten zweiseitigen t- Test. f Boxdiagramme, die den Vergleich der Expression von HIF-1α in jedem Monozytencluster zwischen HAPH-Patienten ( n = 7) und Kontrollen ( n = 5) zeigen. g – i Boxdiagramme, die den Vergleich der Expression von VEGFA in jedem Monozytencluster zwischen HAPH-Patienten ( n = 7) und Kontrollen ( n = 5) zeigen. HIF-1α Hypoxie-induzierbarer Faktor-1α, VEGF vaskulärer endothelialer Wachstumsfaktor, HAPH pulmonale Hypertonie in großer Höhe, NK-Zellen natürliche Killerzellen.
Vergleich der Immunzellzusammensetzungen in PBMCs zwischen HAPH- und PH-PatientenUm die Immunanpassungen mit HAPH und PH zu vergleichen, wurden 6 PH-Patienten rekrutiert (Ergänzungstabelle
5
). Anschließend führten wir eine scRNA-Seq an PBMCs von PH-Patienten durch. Die PH-Immunlandschaft wurde nach dem gleichen Analyse-Workflow dargestellt. Wir identifizierten 11 Zelltypen gemäß den kanonischen Markern, darunter Monozyten, NK-Zellen, CD4 + , CD8 + und regulatorische T-Zellen, Gedächtnis- und naive B-Zellen, cDC, pDC und HSCs (Abb.
7a, b
). Davon machten Monozyten 26,7 % aus. Der Landschaftsvergleich von HAPH und PH zeigte, dass ihre Immunanpassungen sowohl hinsichtlich der Zelltypzusammensetzung als auch der Zellfraktionen in jeder Population ähnlich waren (Abb.
7c, d
). Ähnliche Zellanteile von CD4 + T-Zellen, CD8 + T-Zellen und NK-Zellen wurden in PH wie in HAPH dokumentiert (Abb.
7e, f
). Bemerkenswert ist, dass beim Vergleich der Monozyten-Untergruppen zwischen HAPH und PH C2 einen signifikant höheren Anteil bei HAPH aufwies, was bei C0 und C1 nicht der Fall war (Abb.
7
g). Ein einzelner tSNE aller Proben wurde generiert, um Cluster mit denselben Analyseparametern zu identifizieren (ergänzende Abbildung
18
). tSNE-Diagramme einzelner Proben wurden in ergänzender Abbildung
19
gezeigt . Die Häufigkeiten der drei Monozyten-Untergruppen wurden bei HAPH-Patienten, PH-Patienten und Kontrollpersonen verglichen (ergänzende Abbildung
20
). Insgesamt deutete die scRNA-seq von PBMC darauf hin, dass bei HAPH und PH ähnliche Immunanpassungen existieren könnten.Abb. 7: Immunzellzusammensetzung im Kreislaufsystem von Patienten mit PH und ihr Vergleich mit denen bei HAPH.
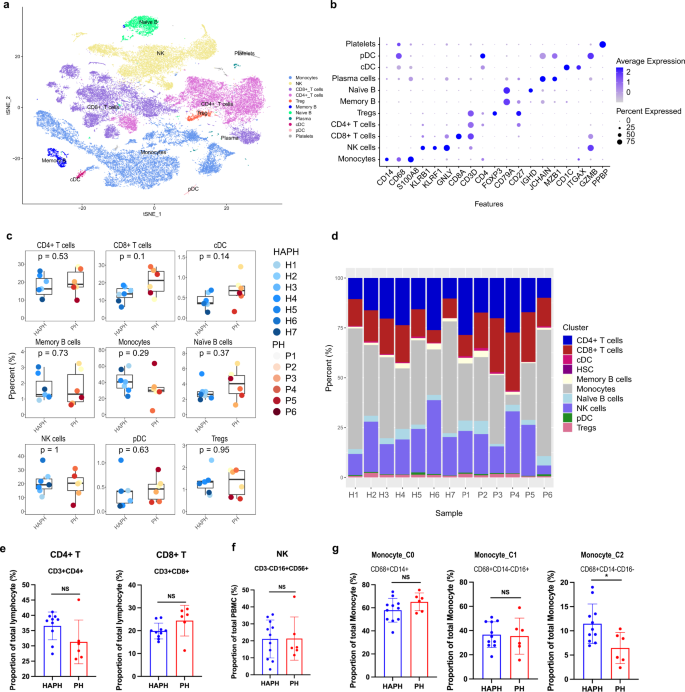 ein t-SNE-Diagramm der wichtigsten Untergruppen der Immunzellen in PBMCs von Patienten mit PH ( n = 6). b Punktdiagramm, das die Prozentsätze und durchschnittlichen Expressionen der kanonischen Gene darstellt, die mit jedem Hauptimmunzellcluster in PBMCs von Patienten mit PH ( n = 6) assoziiert sind. c Boxplots, die die Prozentsätze jedes Hauptzelltyps in PBMCs zwischen HAPH- ( n = 7) und PH- ( n = 6) Patienten vergleichen. Dargestellt sind die zweiseitigen p- Werte aus dem Wilcoxon-Rangsummentest. d Anteile jedes Zelltyps in jeder Probe wie angegeben. ( e – g ) Der Anteil von T-Zellen, NK-Zellen und C0-, C1-, C2-Monozyten-Untergruppen in PBMCs von HAPH- ( n = 11) und PH-Patienten ( n = 6), analysiert durch Durchflusszytometrie (* p < 0,05; ungepaart Der t- Test wurde entsprechend verwendet. Die Daten wurden als Mittelwert ± SD dargestellt . PH pulmonale Hypertonie, HAPH pulmonale Hypertonie in großer Höhe, t-SNE t-verteilte stochastische Nachbareinbettung, PBMCs mononukleäre Zellen des peripheren Blutes.
DiskussionEs gibt immer mehr Hinweise darauf, dass gestörte Immun- und Entzündungsreaktionen in der Pathogenese von PH gipfeln würden. Allerdings gibt es nur begrenzte Studien, die die zirkulierende Immunlandschaft bei Patienten mit HAPH (dritte PH-Kategorie) untersucht haben. Durch die Profilierung der Gensignatur einzelner Immunzellen in PBMCs von HAPH-Patienten oder Kontrollpersonen identifizierten und charakterisierten wir einen ausgeprägten Monozyten-Phänotyp im peripheren Kreislauf in Verbindung mit HAPH.Ein Hauptergebnis unserer Untersuchung ist, dass Monozyten in PBMCs von Patienten mit HAPH häufiger vorkamen als in denen der Kontrollpersonen. Tatsächlich haben frühere Studien versucht zu klären, wie Entzündungen im pathologischen Prozess der PH beim Menschen eine Rolle spielen. Es besteht jedoch kein Konsens darüber, wie Monozyten beteiligt sind, insbesondere bei HAPH. Marsh et al. beobachteten eine Zunahme lymphoider Zellen und eine Abnahme myeloischer Abstammungslinien (z. B. Neutrophile und Monozyten) in PH-Lungengeweben, während in isolierten Lungenarterien eine erhöhte Häufigkeit aktivierter Makrophagen und Monozytenpopulationen festgestellt wurde
24
. Experimentell könnte die Blockierung der Rekrutierung zirkulierender Monozyten zum Schutz vor Bilharziose-induziertem PH
25
beitragen . Hier haben wir Beweise dafür vorgelegt, dass die Monozytenhäufigkeit im Kreislaufsystem von HAPH-Patienten höher war.Als wichtige Mediatoren des angeborenen Immunsystems bestehen Monozyten aus mehreren Subpopulationen, die über unterschiedliche Entwicklungswege erzeugt werden und sich in ihren entzündlichen und wandernden Phänotypen unterscheiden
18
,
26
,
27
. In der vorliegenden Studie berichteten wir über eine faszinierende Beobachtung, dass HAPH-Patienten im Vergleich zu Kontrollpersonen eine deutliche Veränderung des Monozyten-Phänotyps aufwiesen, was sich in einer höheren Häufigkeit von C1- (nicht-klassischen) und C2-Monozyten (intermediären) Monozyten im Vergleich zu C0-Monozyten (klassisch) zeigt. Monozyten in PBMCs von HAPH-Patienten. Darüber hinaus zeigten alle drei Monozyten-Untergruppen einen signifikant verringerten Grad an Phagozytose, myeloischer Zelldifferenzierung, Koagulation und Blutplättchenadhäsion an freiliegendem Kollagen, was auf eine funktionelle Beeinträchtigung in allen Monozyten-Untergruppen bei HAPH-Patienten schließen lässt.Es ist allgemein bekannt, dass klassische Monozyten aus dem Knochenmark stammen, stark phagozytisch sind und über die Aktivität des Chemokinrezeptors CCR2
28
schnell an Entzündungsherde rekrutiert werden können . Zuvor haben Yen-Rei et al. fanden heraus, dass die klassische Monozytenrekrutierung und -akkumulation zwar durch die CCR2-Deletion aufgehoben werden kann, die PH jedoch nicht gelindert wurde und bei CCR2-defizienten Mäusen sogar noch schwerwiegender wurde, was stark darauf hindeutet, dass klassische Monozyten möglicherweise nicht direkt zur Entwicklung von PH beitragen
29
. Dies stimmte mit unseren Daten überein, die zeigten, dass die C0-Monozyten (klassisch) bei HAPH-Patienten nicht signifikant erhöht waren.Kürzlich wurde gezeigt, dass nichtklassische Monozyten sich in kleinen Lungenarterien rekrutieren, sich in pulmonale interstitielle Makrophagen differenzieren und anschließend den Gefäßumbau fördern
14
. Wir zeigten, dass zirkulierende nicht-klassische Monozyten bei HAPH-Patienten durchweg häufiger vorkamen als bei den Kontrollpersonen. Nicht-klassische Monozyten, die nur etwa 2–11 % aller zirkulierenden Monozyten ausmachen, stammen ebenfalls aus dem Knochenmark. Sie sind mobil und können das Mikrogefäßsystem patrouillieren, indem sie auf dem Endothel kriechen und als Reaktion auf Entzündungsreize in subendotheliale Räume eindringen
30
. Daher legen die obigen Ergebnisse nahe, dass nicht-klassische Monozyten an der HAPH-Entwicklung beteiligt sein könnten.Derzeit muss die biologische Relevanz intermediärer Monozyten während der PH noch bestimmt werden. In unseren Einzelzell-Transkriptomanalysen beobachteten wir einen deutlichen Anstieg der zirkulierenden intermediären Monozyten-Untergruppe bei HAPH-Patienten, über den bisher nicht berichtet wurde. Intermediäre Monozyten stellen eine kleine Untergruppe der Blutmonozyten dar und ihre Funktionen umfassen die Produktion reaktiver Sauerstoffspezies (ROS), die Antigenpräsentation, die Zytokinsekretion und die Apoptoseregulation
31
. Interessanterweise scheinen intermediäre Monozyten für die Heilungsphase nach einer Myokardverletzung im Herzen relevant zu sein und als unabhängiger Prädiktor für kardiovaskuläre Ereignisse zu fungieren
32
,
33
,
34.
Es wurde berichtet, dass Menschen mit Bluthochdruck erhöhte Werte an intermediären und nicht-klassischen Monozyten aufweisen und dass NO die Bildung intermediärer Monozyten hemmen kann
35
. In unseren Analysen waren die intermediären Monozyten bei HAPH-Patienten deutlich erhöht, was mit herunterregulierten Signalwegsignaturen wie Phagozytose, Koagulation und Blutplättchenadhäsion an freiliegendem Kollagen einherging. Wie diese Subpopulation an der Pathogenese der PH beteiligt ist, muss jedoch in zukünftigen Studien noch weiter untersucht werden.Darüber hinaus ist ein weiterer interessanter Befund unserer Studie, dass die HIF-1α-Expression in PBMCs von Patienten mit HAPH im Vergleich zur Kontrolle drastisch herunterreguliert war, insbesondere in allen Monozyten-Untergruppen, was auf einen engen Zusammenhang zwischen Hypoxie und Entzündungsreaktionen schließen lässt. Frühere Berichte befassten sich mit der Beteiligung von HIFs an der Hypoxie-induzierten PH-Entwicklung (z. B. PH der WHO-Gruppe 3) in Tiermodellen
36
,
37
. HIFs sind heterodimere α/β-Transkriptionsfaktoren, die verschiedene Gene transaktivieren können, die zum Schutz vor den Folgen einer Hypoxie beitragen können. Obwohl die am besten charakterisierten HIFα-Isoformen, HIF-1α und HIF-2α, an einen identischen Kernkonsensus binden, haben sie in verschiedenen Zelltypen unterschiedliche Funktionen
38
,
39
. Es wurde festgestellt, dass HIF-2α anstelle von HIF-1α die Entwicklung von PH vorantreibt, da die Hemmung des HIF2α-Signals die Auslösung einer durch Hypoxie induzierten PH abschwächt
36
. HIF-1α wird in praktisch allen angeborenen und adaptiven Immunpopulationen weit verbreitet exprimiert und nachgewiesen. Es ist bekannt, dass myeloisches HIF-1α zur Entzündung beiträgt, da eine bakterielle Infektion die HIF-1α-Expression in menschlichen Monozyten induziert
40
. Die Hemmung der Induktion einer trainierten Immunität durch HIF-1α-blockierte Monozyten bezieht sich auf die Fähigkeit des angeborenen Immunsystems, durch metabolische oder epigenetische Neuprogrammierung ein immunologisches Gedächtnis aufzubauen
41
. Daher könnten unsere Daten, die eine Herunterregulierung der HIF-1α-Expression in peripheren Monozyten bei HAPH-Patienten zeigten, auf eine beeinträchtigte Funktion der Monozyten als Reaktion auf Hypoxie hinweisen. Es wurde berichtet, dass immungeschulte Monozyten möglicherweise robuster und schneller auf eindringende Krankheitserreger reagieren, und zwar im Hinblick auf die Produktion proinflammatorischer Zytokine und möglicherweise durch eine verbesserte Phagozytosekapazität
42
. Diese Beobachtung stimmte mit unseren Daten überein. Eine der Möglichkeiten der Diskrepanz könnte in der Tatsache liegen, dass die Zunahme von HIF-1α in Zellen mit einer verstärkten Phagozytose durch pharmakologischen Stress (kurzfristig und akut) im ersteren und langfristige (chronische) Hypoxie-Exposition induziert wurde in großer Höhe kann es zu einer Erschöpfung der Monozyten kommen, die sich in einer Beeinträchtigung der HIF-1α-vermittelten Signalwege (z. B. Phagozytose) äußert. Es könnte auch postuliert werden, dass die Beeinträchtigung der HIF-1α-vermittelten Funktion wiederum die Monozytenexpansion oder -mobilisierung vom Knochenmark ins Knochenmark erleichtern könnte Zirkulation zur Anpassung an die langfristige Hypoxiebelastung, was auf eine höhere Häufigkeit zirkulierender nichtklassischer und intermediärer Monozyten bei HAPH-Patienten zurückzuführen ist.Bei unserer Untersuchung gibt es mehrere Einschränkungen. Die Probengröße war relativ klein und es wurde nur peripheres Blut untersucht. Obwohl unsere Studie einige interessante Erkenntnisse lieferte, werden zukünftige In-vivo- und In-vivo-Studien erforderlich sein, um den Mechanismus zu klären, der der beeinträchtigten HIF-1α-vermittelten Funktion in Monozyten und ihrer Rolle bei der PH zugrunde liegt.Zusammenfassend haben wir Einzelzell-Transkriptomik angewendet, um die zirkulierenden Immunantworten bei HAPH-Patienten zu charakterisieren. Wir stellten fest, dass intermediäre und nicht-klassische Monozyten bei HAPH-Patienten häufiger auftraten, was mit dramatischen Veränderungen in den Monozyten-Phänotypen aller Monozyten-Untergruppen einherging, einschließlich einer Herunterregulierung von HIF-1α und einer beeinträchtigten Genexpression in den Phagozytose-, Gerinnungs- und Wundheilungswegen. Diese Arbeit verdeutlichte einen Zusammenhang zwischen Veränderungen der zirkulierenden Monozyten als Reaktion auf Hypoxie und der Pathophysiologie der HAPH-Entwicklung.
ein t-SNE-Diagramm der wichtigsten Untergruppen der Immunzellen in PBMCs von Patienten mit PH ( n = 6). b Punktdiagramm, das die Prozentsätze und durchschnittlichen Expressionen der kanonischen Gene darstellt, die mit jedem Hauptimmunzellcluster in PBMCs von Patienten mit PH ( n = 6) assoziiert sind. c Boxplots, die die Prozentsätze jedes Hauptzelltyps in PBMCs zwischen HAPH- ( n = 7) und PH- ( n = 6) Patienten vergleichen. Dargestellt sind die zweiseitigen p- Werte aus dem Wilcoxon-Rangsummentest. d Anteile jedes Zelltyps in jeder Probe wie angegeben. ( e – g ) Der Anteil von T-Zellen, NK-Zellen und C0-, C1-, C2-Monozyten-Untergruppen in PBMCs von HAPH- ( n = 11) und PH-Patienten ( n = 6), analysiert durch Durchflusszytometrie (* p < 0,05; ungepaart Der t- Test wurde entsprechend verwendet. Die Daten wurden als Mittelwert ± SD dargestellt . PH pulmonale Hypertonie, HAPH pulmonale Hypertonie in großer Höhe, t-SNE t-verteilte stochastische Nachbareinbettung, PBMCs mononukleäre Zellen des peripheren Blutes.
DiskussionEs gibt immer mehr Hinweise darauf, dass gestörte Immun- und Entzündungsreaktionen in der Pathogenese von PH gipfeln würden. Allerdings gibt es nur begrenzte Studien, die die zirkulierende Immunlandschaft bei Patienten mit HAPH (dritte PH-Kategorie) untersucht haben. Durch die Profilierung der Gensignatur einzelner Immunzellen in PBMCs von HAPH-Patienten oder Kontrollpersonen identifizierten und charakterisierten wir einen ausgeprägten Monozyten-Phänotyp im peripheren Kreislauf in Verbindung mit HAPH.Ein Hauptergebnis unserer Untersuchung ist, dass Monozyten in PBMCs von Patienten mit HAPH häufiger vorkamen als in denen der Kontrollpersonen. Tatsächlich haben frühere Studien versucht zu klären, wie Entzündungen im pathologischen Prozess der PH beim Menschen eine Rolle spielen. Es besteht jedoch kein Konsens darüber, wie Monozyten beteiligt sind, insbesondere bei HAPH. Marsh et al. beobachteten eine Zunahme lymphoider Zellen und eine Abnahme myeloischer Abstammungslinien (z. B. Neutrophile und Monozyten) in PH-Lungengeweben, während in isolierten Lungenarterien eine erhöhte Häufigkeit aktivierter Makrophagen und Monozytenpopulationen festgestellt wurde
24
. Experimentell könnte die Blockierung der Rekrutierung zirkulierender Monozyten zum Schutz vor Bilharziose-induziertem PH
25
beitragen . Hier haben wir Beweise dafür vorgelegt, dass die Monozytenhäufigkeit im Kreislaufsystem von HAPH-Patienten höher war.Als wichtige Mediatoren des angeborenen Immunsystems bestehen Monozyten aus mehreren Subpopulationen, die über unterschiedliche Entwicklungswege erzeugt werden und sich in ihren entzündlichen und wandernden Phänotypen unterscheiden
18
,
26
,
27
. In der vorliegenden Studie berichteten wir über eine faszinierende Beobachtung, dass HAPH-Patienten im Vergleich zu Kontrollpersonen eine deutliche Veränderung des Monozyten-Phänotyps aufwiesen, was sich in einer höheren Häufigkeit von C1- (nicht-klassischen) und C2-Monozyten (intermediären) Monozyten im Vergleich zu C0-Monozyten (klassisch) zeigt. Monozyten in PBMCs von HAPH-Patienten. Darüber hinaus zeigten alle drei Monozyten-Untergruppen einen signifikant verringerten Grad an Phagozytose, myeloischer Zelldifferenzierung, Koagulation und Blutplättchenadhäsion an freiliegendem Kollagen, was auf eine funktionelle Beeinträchtigung in allen Monozyten-Untergruppen bei HAPH-Patienten schließen lässt.Es ist allgemein bekannt, dass klassische Monozyten aus dem Knochenmark stammen, stark phagozytisch sind und über die Aktivität des Chemokinrezeptors CCR2
28
schnell an Entzündungsherde rekrutiert werden können . Zuvor haben Yen-Rei et al. fanden heraus, dass die klassische Monozytenrekrutierung und -akkumulation zwar durch die CCR2-Deletion aufgehoben werden kann, die PH jedoch nicht gelindert wurde und bei CCR2-defizienten Mäusen sogar noch schwerwiegender wurde, was stark darauf hindeutet, dass klassische Monozyten möglicherweise nicht direkt zur Entwicklung von PH beitragen
29
. Dies stimmte mit unseren Daten überein, die zeigten, dass die C0-Monozyten (klassisch) bei HAPH-Patienten nicht signifikant erhöht waren.Kürzlich wurde gezeigt, dass nichtklassische Monozyten sich in kleinen Lungenarterien rekrutieren, sich in pulmonale interstitielle Makrophagen differenzieren und anschließend den Gefäßumbau fördern
14
. Wir zeigten, dass zirkulierende nicht-klassische Monozyten bei HAPH-Patienten durchweg häufiger vorkamen als bei den Kontrollpersonen. Nicht-klassische Monozyten, die nur etwa 2–11 % aller zirkulierenden Monozyten ausmachen, stammen ebenfalls aus dem Knochenmark. Sie sind mobil und können das Mikrogefäßsystem patrouillieren, indem sie auf dem Endothel kriechen und als Reaktion auf Entzündungsreize in subendotheliale Räume eindringen
30
. Daher legen die obigen Ergebnisse nahe, dass nicht-klassische Monozyten an der HAPH-Entwicklung beteiligt sein könnten.Derzeit muss die biologische Relevanz intermediärer Monozyten während der PH noch bestimmt werden. In unseren Einzelzell-Transkriptomanalysen beobachteten wir einen deutlichen Anstieg der zirkulierenden intermediären Monozyten-Untergruppe bei HAPH-Patienten, über den bisher nicht berichtet wurde. Intermediäre Monozyten stellen eine kleine Untergruppe der Blutmonozyten dar und ihre Funktionen umfassen die Produktion reaktiver Sauerstoffspezies (ROS), die Antigenpräsentation, die Zytokinsekretion und die Apoptoseregulation
31
. Interessanterweise scheinen intermediäre Monozyten für die Heilungsphase nach einer Myokardverletzung im Herzen relevant zu sein und als unabhängiger Prädiktor für kardiovaskuläre Ereignisse zu fungieren
32
,
33
,
34.
Es wurde berichtet, dass Menschen mit Bluthochdruck erhöhte Werte an intermediären und nicht-klassischen Monozyten aufweisen und dass NO die Bildung intermediärer Monozyten hemmen kann
35
. In unseren Analysen waren die intermediären Monozyten bei HAPH-Patienten deutlich erhöht, was mit herunterregulierten Signalwegsignaturen wie Phagozytose, Koagulation und Blutplättchenadhäsion an freiliegendem Kollagen einherging. Wie diese Subpopulation an der Pathogenese der PH beteiligt ist, muss jedoch in zukünftigen Studien noch weiter untersucht werden.Darüber hinaus ist ein weiterer interessanter Befund unserer Studie, dass die HIF-1α-Expression in PBMCs von Patienten mit HAPH im Vergleich zur Kontrolle drastisch herunterreguliert war, insbesondere in allen Monozyten-Untergruppen, was auf einen engen Zusammenhang zwischen Hypoxie und Entzündungsreaktionen schließen lässt. Frühere Berichte befassten sich mit der Beteiligung von HIFs an der Hypoxie-induzierten PH-Entwicklung (z. B. PH der WHO-Gruppe 3) in Tiermodellen
36
,
37
. HIFs sind heterodimere α/β-Transkriptionsfaktoren, die verschiedene Gene transaktivieren können, die zum Schutz vor den Folgen einer Hypoxie beitragen können. Obwohl die am besten charakterisierten HIFα-Isoformen, HIF-1α und HIF-2α, an einen identischen Kernkonsensus binden, haben sie in verschiedenen Zelltypen unterschiedliche Funktionen
38
,
39
. Es wurde festgestellt, dass HIF-2α anstelle von HIF-1α die Entwicklung von PH vorantreibt, da die Hemmung des HIF2α-Signals die Auslösung einer durch Hypoxie induzierten PH abschwächt
36
. HIF-1α wird in praktisch allen angeborenen und adaptiven Immunpopulationen weit verbreitet exprimiert und nachgewiesen. Es ist bekannt, dass myeloisches HIF-1α zur Entzündung beiträgt, da eine bakterielle Infektion die HIF-1α-Expression in menschlichen Monozyten induziert
40
. Die Hemmung der Induktion einer trainierten Immunität durch HIF-1α-blockierte Monozyten bezieht sich auf die Fähigkeit des angeborenen Immunsystems, durch metabolische oder epigenetische Neuprogrammierung ein immunologisches Gedächtnis aufzubauen
41
. Daher könnten unsere Daten, die eine Herunterregulierung der HIF-1α-Expression in peripheren Monozyten bei HAPH-Patienten zeigten, auf eine beeinträchtigte Funktion der Monozyten als Reaktion auf Hypoxie hinweisen. Es wurde berichtet, dass immungeschulte Monozyten möglicherweise robuster und schneller auf eindringende Krankheitserreger reagieren, und zwar im Hinblick auf die Produktion proinflammatorischer Zytokine und möglicherweise durch eine verbesserte Phagozytosekapazität
42
. Diese Beobachtung stimmte mit unseren Daten überein. Eine der Möglichkeiten der Diskrepanz könnte in der Tatsache liegen, dass die Zunahme von HIF-1α in Zellen mit einer verstärkten Phagozytose durch pharmakologischen Stress (kurzfristig und akut) im ersteren und langfristige (chronische) Hypoxie-Exposition induziert wurde in großer Höhe kann es zu einer Erschöpfung der Monozyten kommen, die sich in einer Beeinträchtigung der HIF-1α-vermittelten Signalwege (z. B. Phagozytose) äußert. Es könnte auch postuliert werden, dass die Beeinträchtigung der HIF-1α-vermittelten Funktion wiederum die Monozytenexpansion oder -mobilisierung vom Knochenmark ins Knochenmark erleichtern könnte Zirkulation zur Anpassung an die langfristige Hypoxiebelastung, was auf eine höhere Häufigkeit zirkulierender nichtklassischer und intermediärer Monozyten bei HAPH-Patienten zurückzuführen ist.Bei unserer Untersuchung gibt es mehrere Einschränkungen. Die Probengröße war relativ klein und es wurde nur peripheres Blut untersucht. Obwohl unsere Studie einige interessante Erkenntnisse lieferte, werden zukünftige In-vivo- und In-vivo-Studien erforderlich sein, um den Mechanismus zu klären, der der beeinträchtigten HIF-1α-vermittelten Funktion in Monozyten und ihrer Rolle bei der PH zugrunde liegt.Zusammenfassend haben wir Einzelzell-Transkriptomik angewendet, um die zirkulierenden Immunantworten bei HAPH-Patienten zu charakterisieren. Wir stellten fest, dass intermediäre und nicht-klassische Monozyten bei HAPH-Patienten häufiger auftraten, was mit dramatischen Veränderungen in den Monozyten-Phänotypen aller Monozyten-Untergruppen einherging, einschließlich einer Herunterregulierung von HIF-1α und einer beeinträchtigten Genexpression in den Phagozytose-, Gerinnungs- und Wundheilungswegen. Diese Arbeit verdeutlichte einen Zusammenhang zwischen Veränderungen der zirkulierenden Monozyten als Reaktion auf Hypoxie und der Pathophysiologie der HAPH-Entwicklung.







OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
Bitte Anmelden oder Registrieren um der Konversation beizutreten.